Questões de Concurso
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 382 questões
Com relação às ligações químicas entre os átomos que compõem a molécula de gás carbônico é correto afirmar:
− Hematita: Fe2O3; − Magnetita: FeO.Fe2O3; − Siderita: FeCO3; − Goethita: FeO(OH); e − Pirita: FeS2. É correto afirmar que
O elemento químico Boro, forma extraordinárias estruturas. É minerado como bórax e quernita, Na2B4O7. x H2O, com x =10 e 4, respectivamente. Grandes depósitos desse metalóide são encontrados em regiões vulcânicas, sendo na região do Deserto de Monjave, Califórnia, a maior fonte de Boro sob a forma de quernita.
Sobre o boro, analise as seguintes sentenças:
I. Apresenta octeto incompleto em todos os seus compostos
II. Possui alta energia de ionização
III.Forma ligações covalentes com o silício
IV.É comumente encontrado como sólido não metálico com baixo ponto de fusão
V. Alguns de seus compostos têm octetos incompletos e outros são eletrodeficientes
Das sentenças citadas acima, estão corretas:
Algumas baterias primárias e secundarias comercializadas no país, ainda podem conter em sua composição metais pesados altamente tóxicos, como o Pb, Hg e Cd. A bateria de chumbo é um exemplo de bateria secundária ou recarregável. Dentre suas diversas aplicações, ela é responsável pela ignição e funcionamento da parte elétrica dos automóveis, pelo tracionamento de alguns motores elétricos e por manter em funcionamento alguns equipamentos em caso de queda do fornecimento de eletricidade (no-break).
A equação PbO2 (s) + H2SO4 (aq) + Pb(s) → PbSO4(s) + H2O (l), não balanceada, representa essa bateria. Pode-se afirmar que:
Considere as afirmativas a seguir, tendo como referência a classificação periódica dos elementos.
I No grupo dos calcogênios, que quer dizer “originário da prata”, existe o elemento oxigênio que é prescindível à vida e presente em grande número de compostos.
II Os gases nobres eram também chamados de gases inertes, isto é, aqueles que não reagem; mas desde 1982 tal característica foi abandonada devido à síntese de vários compostos com o xenônio.
III Os elementos químicos bromo e mercúrio são líquidos, e os halogênios são formadores de sais.
IV O elemento químico berílio não forma facilmente o íon Be2+.
V O fósforo e o arsênio não formam íons simples, e o antimônio e o bismuto formam apenas cátions de carga 3+ devido ao efeito do par inerte.
Das afirmativas acima, estão corretas apenas:
“O boro forma uma série notável de compostos binários com o hidrogênio – os boranos. Esses compostos incluem o diborano, B2 H6 , e compostos mais complexos, como o decaborano, B10H14”
(JONES, L.; ATKINS, P. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman. 2011.p.632)
Moléculas como o diborano são deficientes em elétrons e, por isso, não podemos escrever estruturas de Lewis válidas. Duas ligações B-H-B são formadas na molécula, formando pontes de hidrogênio. Esse padrão de ligação também é visto no hidrogênio protonado (H3 + ), por exemplo. Como são conhecidas ligações como as pontes presentes no diborano?
A forma como alguns temas são abordados no ensino de química, leva o estudante a imaginar química como uma ciência abstrata, dificultando o processo de ensino e aprendizagem. Para o ensino do conteúdo de modelos moleculares pode-se fazer uso de métodos alternativos didáticos que promovam a melhor visualização das ligações químicas entre átomos e a consequente formação de moléculas e seu arranjo espacial.
A tabela abaixo mostra a relação dos diferentes tipos de átomos com respectivos ângulos de ligação e formato destes no modelo:
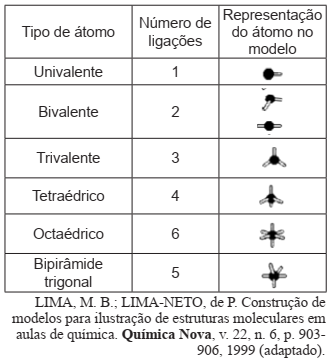
Com base nessas informações e em seus conhecimentos sobre geometria molecular, pode-se afirmar que, a geometria molecular:
O gráfico apresentado a seguir relaciona os pontos de ebulição dos compostos formados por elementos da família 5A e hidrogênio em função do número atômico do elemento.

As propriedades que explicam os fatos de o ponto
de ebulição da amônia ser maior que o da fosfina e
menor que o do hidreto de bismuto (III) são:
Considerando as espécies químicas H+
, Cu+
, Mg2+, BF3, Au+
, NH4+
, BH3, F-
, NH3, I- e
C6H6, responda a questão.
Sobre as espécies apresentadas não se pode afirmar que
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
I – Aqueles com maior ponto de fusão são os óxidos de sódio e magnésio. II – O enxofre forma mais de um óxido. III – A ligação entre Mg e O é a que apresenta maior caráter iônico. IV – O dióxido de cloro (ClO2) apresenta fórmulas de Lewis com híbridos de ressonância.
Está correto o que se afirma em
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
Considerando as substâncias formadas pela ligação química de um átomo de carbono com i) 4 átomos de hidrogênio, ii) dois átomos de oxigênio e iii) um átomo de oxigênio e dois de hidrogênio, tem-se as afirmativas:
I- Uma das moléculas formadas apresenta geometria trigonal plana.
II- Uma delas possui ângulo de ligação igual a 104,5 °.
III- Todos são moléculas polares.
IV- Entre as forças intermoleculares presentes, não há, em nenhum caso, ligação de hidrogênio.
V- O composto formado por carbono e oxigênio deve apresentar o menor ponto de fusão entre os três.
Está correto o que se afirma em
I- Devido à eletronegatividade de seus elementos, possui geometria angular. II- Sua base conjugada é o íon carboneto. III- Trata-se de um composto covalente. IV- Seu átomo de carbono tem hibridação sp3 . V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Os sólidos estão divididos em duas grandes categorias: sólidos cristalinos e sólidos amorfos. Por sua vez os sólidos cristalinos podem ser iônicos, covalentes ou metálicos. Analise as proposições abaixo, e assinale com V as verdadeiras e com F as falsas.
( ) Os sólidos amorfos, líquidos super-resfriados ou vidros apresentam partículas dispostas desordenadamente.
( ) O diamante apresenta ligações com orbitais sp2 e o grafite apresenta ligações com orbitais sp3.
( ) O dióxido de silício é um sólido covalente porque cada átomo de oxigênio está ligado a dois átomos de silício.
( ) Nos sólidos metálicos existe uma rede em que os pontos reticulares estão ocupados por íons unidos por ligações do tipo metálico não direcionais.
( ) Gelo e dióxido de carbono são exemplos de sólidos moleculares porque possuem unidades moleculares discretas com ligações dipolares ou de hidrogênio.
A sequência correta, de cima para baixo, é
A geometria molecular e o tipo de hibridação do átomo central no tetrafluoreto de xenônio são, respectivamente,

A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.