Questões de Concurso Sobre química
Foram encontradas 13.580 questões
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
O teor de cálcio da referida amostra é superior a 3,0 g/L.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
Sabendo-se que as constantes de formação dos complexos de
Mg2+ e Zn2+ com EDTA são 4,9 × 108
e 3,2 × 1016,
respectivamente, é correto afirmar que o pH mínimo necessário
para a realização da titulação de complexação de Zn2+ é menor
que o do cátion Mg2+.
Diversas propriedades moleculares e de diferentes tipos de materiais podem ser explicadas por meio da distribuição eletrônica dos átomos, da estrutura molecular e das forças intermoleculares que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos elementos, julgue o item subsecutivo.
De acordo com a teoria da repulsão entre os pares de elétrons
da camada de valência, depreende-se que os compostos NOF,
BrF5 e CF4 possuem, respectivamente, geometria molecular
angular, piramidal quadrada e tetraédrica.
Diversas propriedades moleculares e de diferentes tipos de materiais podem ser explicadas por meio da distribuição eletrônica dos átomos, da estrutura molecular e das forças intermoleculares que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos elementos, julgue o item subsecutivo.
Considere que os pontos de ebulição (em °C) dos hidretos dos
elementos O, S, Se e Te sejam aproximadamente iguais a 100, -55, -45 e -20, respectivamente. Nesse caso, é correto
afirmar que o comportamento anômalo do H2O nessa série se
deve às forças de dipolo-induzido, que são muito maiores que
as interações presentes nos outros compostos.
Diversas propriedades moleculares e de diferentes tipos de materiais podem ser explicadas por meio da distribuição eletrônica dos átomos, da estrutura molecular e das forças intermoleculares que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos elementos, julgue o item subsecutivo.
As principais forças intermoleculares presentes na forma
líquida de metano, fluoreto de metila e álcool metílico são,
respectivamente: forças de dispersão de London, interações
dipolo-dipolo e interações íon-dipolo.
Diversas propriedades moleculares e de diferentes tipos de materiais podem ser explicadas por meio da distribuição eletrônica dos átomos, da estrutura molecular e das forças intermoleculares que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos elementos, julgue o item subsecutivo.
A molécula de amônia apresenta hibridização sp3
, geometria
molecular piramidal trigonal e pode ser considerada uma base
de Brønsted-Lowry.
Diversas propriedades moleculares e de diferentes tipos de materiais podem ser explicadas por meio da distribuição eletrônica dos átomos, da estrutura molecular e das forças intermoleculares que atuam entre as moléculas.
Considerando essas informações e a classificação periódica dos elementos, julgue o item subsecutivo.
O trifluoreto de cloro é uma molécula que apresenta geometria
molecular em T e hibridização sp3d.
Observe a figura do equipamento laboratorial, a seguir

Esse equipamento é indicado para:
De modo geral, na técnica de absorção atômica, a solução que contém o analito de interesse é inserida no equipamento sob a forma líquida, e é convertida em um fino aerossol antes de atingir o atomizador.
Assinale a alternativa que apresenta o modo de
atomização mais adequado à afirmativa descrita
anteriormente.
Muitos íons metálicos formam complexos estáveis, solúveis em água, com muitas aminas terciárias. A formação desses complexos serve como base nas titulações complexométricas de íons metálicos.
Sobre as titulações complexométricas, assinale a alternativa INCORRETA.
A produção comercial do ácido nítrico envolve as seguintes reações químicas:
I. 4NH3(g) + 5O2(g ) → 4NO(g) + 6H2O(g)
II. 2NO(g) + O2(g) → 2NO2(g)
III. 3NO2(g) + H2O(L) → 2HNO3(aq) + NO(g)
É correto afirmar que são reações de oxirredução as descritas em:
Em todas as grandes áreas da Química e, em especial, na Química Analítica, é necessário que o profissional saiba distinguir e utilizar convenientemente cada equipamento volumétrico de modo a reduzir ao mínimo os erros nas análises.
Sobre os instrumentos volumétricos, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) As pipetas e buretas são instrumentos construídos e calibrados para contenção de volumes.
( ) A precisão alcançável com uma pipeta é substancialmente maior que a precisão de uma bureta.
( ) Os frascos volumétricos são utilizados para a preparação de soluções-padrão e para a diluição de amostras, a volumes fixos, antes da tomada de alíquotas com uma pipeta.
( ) As buretas são instrumentos volumétricos de transferência de líquidos utilizadas para escoar volumes variáveis e empregadas geralmente em titulações.
Assinale a sequência CORRETA.
A curva para a titulação de um ácido fraco por uma base forte é muito similar no formato àquela para a titulação de um ácido forte por uma base forte. Quando ácidos fracos contêm mais de um átomo de hidrogênio ionizável, como no ácido fosfórico (H3PO3 ), a reação com OH- ocorre em uma série de etapas.
Considere o gráfico a seguir, que representa a curva de titulação para a reação de 50 mL de 0,1 mol/L de H3PO3 com 0,1 mol/L de NaOH.
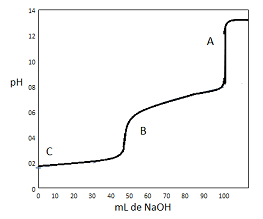
Segundo a curva de titulação, as espécies químicas A, B
e C são, respectivamente:
Nos anos de 1950, tanto os Estados Unidos quanto a antiga União Soviética tinham programas para usar o decaborano (B10H14) como combustível de foguete. Esse composto reage violentamente com oxigênio, de acordo com a equação química a seguir.
B10H14 + 11 O2 → 5 B2O3 + 7 H2O
Na tentativa de simular a eficiência máxima do foguete, considere que um engenheiro elaborou um projeto que consumiu o decaborano (B10H14) com 80% de pureza.
Sabendo que 10 mil kg do decaborano foram colocados para reagir com oxigênio, aproximadamente quantos mols de moléculas do B2O3 foram produzidos na reação?
A espectroscopia de absorção atômica em chama (EAA) é correntemente o método atômico mais empregado em razão de sua simplicidade, efetividade e custo relativamente baixo.
Numere a COLUNA II de acordo com a COLUNA I relacionando os instrumentos empregados na técnica de absorção atômica à sua aplicabilidade.
COLUNA I
1. Fonte
2. Célula de absorção
3. Monocromador
4. Detector
5. Registrador
COLUNA II
( ) Mede a intensidade de luz e a transforma em sinal elétrico.
( ) Mostra a leitura depois de o sinal ser processado.
( ) Emite o espectro do elemento de interesse.
( ) Seleciona o comprimento de onda a ser utilizado.
( ) Local onde os átomos da amostra são produzidos.
Assinale a sequência CORRETA.
Sobre alguns compostos moleculares, considere que um estudante faz as seguintes classificações:
I. Composto CO2 (forma geométrica linear e molécula apolar).
II. Composto H2S (forma geométrica angular e molécula polar).
III. Composto CH2O (forma geométrica tetraédrica e molécula polar).
Estão corretas as classificações:
Considere, hipoteticamente, que, em um estudo cinético de formação do composto AB, a reação ocorre nas seguintes condições experimentais: uma reação de primeira ordem em relação a A e de segunda ordem em relação a B.
Nessas condições, a velocidade da reação química aumenta quantas vezes se as concentrações das espécies A e B forem duplicadas?
Considere que no preparo de uma solução de HCl 0,1 mol/L um técnico utiliza 4,5 mL da solução de estoque do reagente concentrado. A solução de estoque tem as seguintes especificações:

Nessas condições, e para garantir uma concentração
mais próxima possível daquela que o técnico pretende,
é correto afirmar que o balão volumétrico utilizado para
o preparo dessa solução é de:
A segurança dos profissionais da área de Química nos laboratórios é extremamente importante para o bom desempenho das atividades experimentais. Com a finalidade de reduzir a frequência e a gravidade de acidentes nos laboratórios, torna-se absolutamente imprescindível que, durante os trabalhos realizados, se observe uma série de normas de segurança. A armazenagem dos reagentes, por exemplo, deve ser com seus rótulos originais e, quando isto não for possível, a etiqueta deve conter, no mínimo, o nome químico do reagente, sua composição e os principais riscos.
Sobre os possíveis riscos à saúde decorrentes da exposição a alguns produtos químicos, assinale a afirmativa INCORRETA.