Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
Para preparar 1.000 mL de uma solução aquosa de HCl 0,100 mol/L, será necessário utilizar um volume da solução estoque de HCl superior a 10,0 mL
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
No procedimento de titulação, a solução titulante deve ser adicionada lentamente à solução titulada por meio de uma pipeta volumétrica.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O manganês é um metal de transição externa do quarto período da tabela periódica. O número de oxidação máximo que ele assume ao se combinar com outros elementos para formar compostos é igual a +7.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

A equação da reação de oxirredução da água oxigenada com permanganato de potássio em meio ácido mostrada a seguir está corretamente balanceada.
MnO4 - ( aq) + H2O2 (aq) + 2H+(aq ) → Mn 2+ ( aq) + 2H2O( l ) + 2O2(g).
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando o comportamento ideal para o gás, a decomposição completa de 17,0 g de água oxigenada em H2O( l ) e O2 (g) libera um volume de O2(g), medido nas CNTP, superior a 5,0 L.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando-se condições em que o tempo de meia-vida da água oxigenada seja igual a 2 anos, é correto afirmar que em um período de 8 anos haverá a decomposição de mais de 90% da quantidade inicial de água oxigenada contida em uma solução.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

De acordo com o gráfico apresentado, a reação em questão é uma reação de primeira ordem em relação à concentração da água oxigenada.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O cloreto férrico aumenta a energia de ativação da reação, de forma que maior fração das moléculas de água oxigenada terá energia suficiente para ativar a reação.
Em meio aquoso, ele se ioniza de acordo com a equação simplificada (I) abaixo.
(I) HC2H3O2(aq)
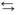 H+(aq) + C2H3O2−(aq)
H+(aq) + C2H3O2−(aq) Ácido clorídrico é um ácido muito forte e, em meio aquoso, ele se ioniza de acordo com a equação simplificada (II) abaixo.
(II) HCl(aq) → H+(aq) + Cl−(aq)
Na reação da base forte hidróxido de sódio 0,1 mol/L com o ácido etanoico 0,1 mol/L, e com o ácido forte
 0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações:
0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações: (III) NaOH(aq) + HC2H3O2(aq) → NaC2H3O2(aq) + H2O(l)
(IV) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sobre a ionização em (I) e (II) e as reações de neutralização em (III) e (IV), tem-se que:
KMnO4(aq) + SnSO4(aq) + H2SO4(aq) → MnSO4(aq) + Sn(SO4)2(aq) + K2SO4(aq) + H2O( l)
Considere as afirmações abaixo sobre essa reação.
I - MnO4 - é o agente oxidante no meio ácido, e Sn2+ , o agente redutor.
II - No balanço de massa, 2 mol de KMnO4 reagem com 5 mol de SnSO4 .
III - Sn2+ ganha 2 elétrons do MnO4 - ao passar para Sn4+ .
É correto APENAS o que se afirma em
S(s) + ½ O2(g) → SO(g)
SO(g) + ½ O2(g) → SO2(g)
SO2(g) + ½ O2(g) → SO3(g)
SO3(g) + H2O(l) → H2SO4(aq)
Considerando rendimento de 80% na formação de ácido sulfúrico a partir do S, a massa, em g, do ácido produzida a partir de 50,0 g da amostra original é, aproximadamente,
H2O(g) → H2(g) + ½ O2(g) ΔHo = 285 kJ
Nessa reação,
A respeito dessas misturas, tem-se que
Zn+2 + 2e-1 = Zn -0,763
Fe+3+ 3e-1 = Fe -0,037
2H+1 + 2e-1 = H2 0,000
Cu+2 + 2e-1 = Cu 0,337
Fe+3 + e-1 = Fe+2 0,771
Ag+1+ e-1 = Ag 0,7991
Au+1+ e-1 = Au 1,692
A tabela de potenciais de redução é muito útil para avaliar a possibilidade de oxidação de metais distintos, unidos eletricamente e imersos em um eletrólito. A tabela acima fornece alguns valores para diferentes sistemas de oxidação.
Sendo assim, empregando-se essa tabela, verifica-se que