Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Essa situação está normalmente associada à corrosão
Na nitração mostrada na reação acima, são adicionados 5 moles de benzeno e 6 moles de ácido nítrico.
Após 1 hora de reação, obtém-se uma conversão de 60%.
O número de moles de reagente limitante que resta na reação e a massa, em gramas, formada de produto são, respectivamente,
Dados:
Massa Atômica do Carbono = 12
Massa Atômica do Oxigênio = 16
Massa Atômica do Nitrogênio = 14
Massa Atômica do Hidrogênio = 1
Nesse processo, normalmente, o agente limitante e o reagente em excesso são, respectivamente,
Al2 O3 + 2 NaOH → 2 NaAlO2 + H2O
Se a bauxita a ser tratada tem 50% (m/m) de óxido de alumínio e a quantidade a ser tratada é 1.020 toneladas, quantas toneladas de solução de soda cáustica devem ser utilizadas?
Dados:
Massa Atômica do Alumínio = 27
Massa Atômica do Sódio = 23
Massa Atômica do Hidrogênio = 1
Massa Atômica do Oxigênio = 16
Densidade da Água = 1,0 kg/L
I - Na medição de pH, pode-se usar um termocompensador para corrigir os efeitos da variação de temperatura sobre o eletrodo de membrana de vidro.
II - Os condutivímetros são utilizados na monitoração da água deionizada e em linhas de retorno de condensado.
III - Em um cromatógrafo, a separação dos vários componentes da amostra ocorre na coluna cromatográfica.
Está correto o que se afirma em
Considerando que a quantidade de eletricidade (carga) de 1 mol de elétrons é igual a 96.500 C, qual o tempo, em s, necessário para se obter 9,2 g de sódio, por esse processo, utilizando uma corrente constante e igual a 10 A?
Numa viagem de 200 km, com o carro consumindo, na média, 10 km/L, ao concluir esse percurso, a quantidade máxima de energia liberada, em kJ, será, aproximadamente, igual a
Na refinaria, que tipo de processo se utiliza para gerar mais gasolina?
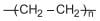
O monômero utilizado na síntese desse polietileno é um
Dados: M (CH3 CH2 OH) = 46 g/mo
CH3 CH2 OH(
 ) + 6 O2 (g) → 2 CO2 (g) + 3H2 O(
) + 6 O2 (g) → 2 CO2 (g) + 3H2 O( ) ΔH° = -1.400 kJ
) ΔH° = -1.400 kJSe 9,2 kg de etanol são queimados de forma completa, e o calor liberado é aproveitado com 90% de eficiência, a energia útil, em kJ, no processo, é
 ) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.
) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.HC
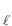 (g) + NH3(g) ? NH4 C
(g) + NH3(g) ? NH4 C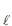 (s)
(s)Considerando-se a pressão de vapor do NH4 C
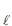 insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, é
insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, éDado: R = 0,082 atm · L · mol -1· K-1
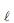 é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as)
é boa condutora de eletricidade. Se essa solução for atravessada por uma corrente elétrica, serão portadores de carga os(as) A concentração da espécie MnO4- , em mol/L, nessa solução, é
Dado: M(KMnO4 ) = 158 g/mol
A massa de NaOH, em g, que deve ser utilizada para neutralizar todo o ácido sem que haja excesso de base é
Dados:
M(KOH) = 56 g/mol
M(NaOH) = 40 g/mol
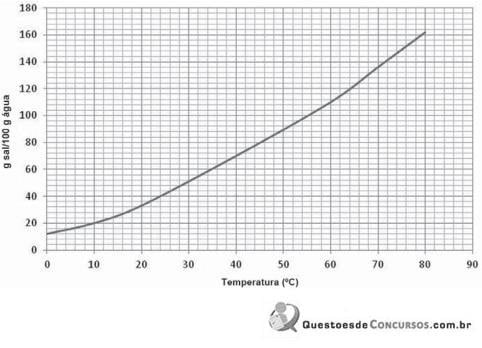
Uma solução saturada desse sal pesando 170 g e na temperatura de 40 °C foi resfriada a 10 °C. A massa do sal, em g, que precipita formando um sólido no fundo do frasco (corpo de fundo) é aproximadamente igual a
AgNO3 (aq) + KI (aq) ? AgI (s) + KNO3 (aq)
Levando-se em conta a estequiometria da reação e o conceito de reagente limitante, e sendo as massas molares do AgNO3 = 170 g/mol e do KI = 166 g/mol, após a reação
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco