Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 327 questões
O hidrogênio é um elemento que forma compostos binários com vários outros elementos, metais e ametais, formando substâncias com propriedades químicas e físicas muito variadas. Em alguns casos, formam-se hidretos, que são compostos em que o hidrogênio é o elemento mais eletronegativo. Abaixo são mostrados alguns compostos binários de hidrogênio:

Entre os exemplos citados, há quantos hidretos?
O ácido monoprótico, representado por HX, é misturado com excesso de Ba(OH)2 , reagindo segundo a equação abaixo.

Foram obtidos 15,00 g do produto BaX2 que foram quantitativamente reagidos com exatamente 59,00 mL de uma solução aquosa de ácido sulfúrico 1,00 mol L-1 , como mostrado na equação abaixo.
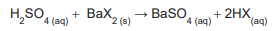
A partir dos dados do experimento, calculou-se a massa
molar de HX, em g mol -1
, e concluiu-se que era de 
(volume molar = 22,4L em 25°C)
A reação que ocorre é: Ag2S(s) + Aℓ(s)→ Aℓ2S3(s) + Ag(s)
Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 5g de sulfeto de prata I é aproximadamente:
O sulfato de bário, substância muito utilizada em exames radiológicos, pode ser obtido por meio de uma reação entre o ácido sulfúrico e o hidróxido de bário, conforme reação equacionada a seguir:
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Considerando que a reação tem um rendimento de 80%, a massa, em gramas, de sulfato de bário obtido, quando são utilizados 0,05 kg de hidróxido de bário, será aproximadamente de:
Massas atômicas: H = 1; Ba = 137; S = 32; O = 16.
O airbag, também conhecido como bolsa de ar, é um componente de segurança dos veículos automotores. O sistema de enchimento dessa bolsa é constituído por uma resistência elétrica e pela mistura de três substâncias: azida de sódio, nitrato de potássio e óxido de silício.
Internet: <chc.cienciahoje.uol.com.br> (com adaptações).
As fórmulas moleculares do nitrato de potássio e do óxido de silício, substâncias presentes no airbag, são expressas, respectivamente, por
Dados: Massa atômica do Na = 23 u Massa atômica do Cl = 35,5 u
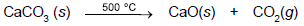
Considerando-se que a areia permaneceu sem reagir durante todo o procedimento de análise, o teor percentual de CaCO3 na amostra impura de calcário é
CoBr3(aq) + Na2CO3(aq) → Co2(CO3)3(s) + NaBr(aq)
Na equação balanceada, os coeficientes estequiométricos dos reagentes e produtos, na ordem e sequência em que são apresentados na equação são:
Dado: Constante de Avogadro 6,0 × 1023 /mol
Considere as informações a seguir para responder à questão.
Na verificação qualitativa de íons iodato, IO-3 , foi realizado o teste com íons iodeto em meio ácido, segundo a equação não balanceada:
IO-3 (aq) + I-(aq) + H+(aq) → I2(s) + H2O(ℓ)
Para identificar a formação do I2 (s), toma-se uma alíquota da amostra após a reação, adiciona-se clorofórmio e agita-se. Ao final, se o iodo estiver presente, é observada coloração violeta rosada na fase orgânica.
Dado: Volume molar de gás, nas CATP = 25 L/mol.
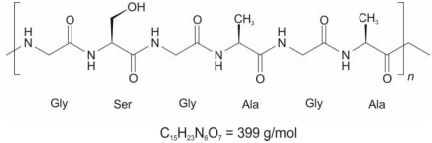
Nessa sequência de estrutura, a porcentagem em massa de nitrogênio é de
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s)  Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é