Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.464 questões
CO(g) + H2(g) → CH3OH(l)
Ni(s) + CO(g) → Ni(CO)4(g)
Considerando as massas molares, em g/mol, do Ni = 59, C = 12 e O = 16, qual a massa de Ni(CO)4 obtida, em kg, aproximadamente, dado que 20 kg de níquel metálico foram volatilizados?
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente:
Dados eventualmente necessários: massas molares (g/mol): A = 23; C = 12; O = 16; Cl = 35,5; H = 1.
Dados: massas molares (g.mol-1): S =32; Fe=56.
Se 44kg de sulfeto de ferro(II) contendo impurezas inertes produziram 6,8kg de gás sulfídrico, a porcentagem de pureza desse sulfeto é de
Dado: R = 0,082 atm.L.mol–1. K –1
Um produto químico comum, o tricloroetileno, pode estar associado a um aumento do número de casos de doença de Parkinson no mundo, garante um grupo de cientistas internacionais. Este composto é um solvente usado para descafeinar café, desengordurar metais e lavar roupas a seco.
Adaptado de: https://oglobo.globo.com/saude/medicina/noticia/2023. Acesso em 02/04/2023.
Assinale a opção que indica a fórmula molecular do produto químico citado no texto.
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
Considerando o sal comum formado apenas por cloreto de sódio, a quantidade máxima de sal que pode ser utilizada por dia, por pessoa, segundo a OMS é de, aproximadamente,
Dados: massas molares (g.mol-1): Na =23; Cℓ =35,5.

O gás CO2 de um extintor de incêndio é mais denso do que o ar. À medida que o CO2 sai do extintor, resfria-se significativamente. O vapor d´água no ar é condensado pelo CO2 frio e forma uma nuvem branca.
O fator que faz com que o gás que sai do extintor seja mais denso que o ar é a
Esse alerta tem sido feito pelos Conselhos Regionais de Química frente às informações veiculadas nas mídias digitais. A mistura de água sanitária com vinagre, por exemplo, produz gás cloro que é altamente tóxico.
Os princípios ativos encontrados nos dois produtos citados são
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
Considerando a formação do metano, a partir da reação:
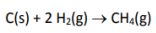
Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
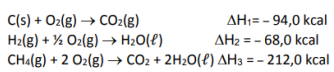
Assinale a alternativa correta.