Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
Temos então a fórmula empírica como sendo ______. Porém, para sair da fórmula mínima e chegar à fórmula molecular, necessita-se saber que a massa molar desse composto é 220 g mol-1 . Sabendo-se que ______ é o número de unidades mínimas dentro da molécula, sabe-se que a molécula estudada é a ______.
Assinale a alternativa que preencha correta e respectivamente as lacunas.
O processo de obtenção do ferro nos alto-fornos consiste no aquecimento do óxido de ferro (III) na presença de monóxido de carbono, resultando em ferro metálico e dióxido de carbono.
A massa de ferro máxima, em quilogramas, que pode ser obtida no altoforno a partir de 80 toneladas de óxido de ferro (III), admitindo-se a quantidade suficiente de monóxido de carbono e o rendimento de 75%, é, aproximadamente, igual a
Inserida no campo da volumetria oxidimétrica, a determinação permanganimétrica de nitrito se dá em meio ácido, onde o ânion nitrito é quantitativamente oxidado a nitrato pelo ânion permanganato, observando-se também a produção de cátion bivalente de manganês e água. A soma dos coeficientes de acerto da equação descrita, estequiometricamente balanceada, contendo os menores valores numéricos e inteiros, é igual a:
(Dados, em g/mol: 8=32, H= 1, 0=16; log 2 =0,3; considerar todos os hidrogênios ionizáveis)
Para a reação x + Y ➔ z ,foram realizados três experimentos conforme a tabela abaixo:
...
Experimento |
[X] mol/L |
[Y] mol/L |
Velocidade de reação mol/(L.min) |
I |
0,2 |
0,3 |
4,0x10-2 |
II |
0,4 |
0,6 |
16,0x10-2 |
III |
0,2 |
0,6 |
8,0x10-2 |
...
Em relação à reação acima, pode-se afirmar que a velocidade de formação de Z quando as concentrações de X e Y forem ambas 0,4 M é:
A figura ilustra esquematicamente um processo de remediação de solos contaminados com tricloroeteno (TCE), um agente desengraxante. Em razão de vazamentos de tanques de estocagem ou de manejo inapropriado de resíduos industriais, ele se encontra presente em águas subterrâneas, nas quais forma uma fase líquida densa não aquosa (DNAPL) que se deposita no fundo do aquífero. Essa tecnologia de descontaminação emprega o íon persulfato (S2O82−), que é convertido no radical •SO4− por minerais que contêm Fe(III). O esquema representa de forma simplificada o mecanismo de ação química sobre o TCE e a formação dos produtos de degradação.
BERTAGI, L. T.; BASÍLIO, A. O.; PERALTA-ZAMORA, P. Aplicações ambientais de persulfato: remediação de águas subterrâneas e solos contaminados. Química Nova, n. 9, 2021 (adaptado).
Esse procedimento de remediação de águas subterrâneas baseia-se em reações de
Dados:
• Massa Molar do CaCO3 = 100 g/mol • Ca + CO2 → CaCO3
Dados:
• Densidade do álcool: 0,791 g/cm³ • Temperatura = 20 °C
Dados:
• H = 1 • N = 14
A fórmula molecular do precursor do ibuprofeno é C9H10O2.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
A soma das quantidades de matéria dos reagentes é igual à
soma das quantidades de matéria dos produtos.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.
I. Existem 2,53 x 1024 átomos de H em 0,350 mol de C6H12O6. II. Em uma molécula de tetracloreto de carbono existem 1,02 x 10-22 g. III. São produzidas 0,3 g de água na oxidação de 1 g de glicose – C6H12O6.
Está correto o que se afirma apenas em
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
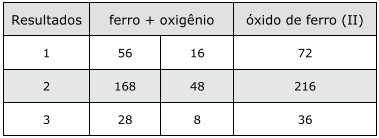
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
O iso-octano é o constituinte que está em maior proporção na gasolina automotiva. Para que a combustão desse hidrocarboneto seja completa, de acordo com a equação, qual será a razão molar
C8H18 : O2?
Considere a equação não balanceada
C8H18(l) + O2(g) → CO2(g) + H2O (g)