Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.439 questões
A reação de decomposição do HI em H2 e I2 pode ocorrer de acordo com o gráfico.
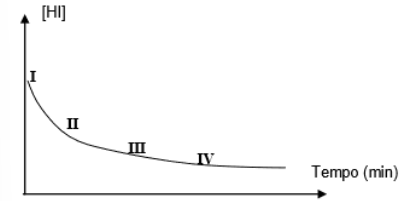
Em relação a expressão de equilíbrio em
função das massas desta reação tem-se:
C2H2 + HCl ➔ C2H3Cl
Dados de massa atômica: C=12,0g, H=1,0g, Cl= 35,5. Ao reagir 51g de HCl com 35g de C2H2 será obtida a massa de cloreto de vinila igual a
Em relação a essa operação é correto dizer que
Fe2(SO4)3 + NaOH → Fe(OH)3 + Na2SO4
O peróxido de hidrogênio, H2O2, quando em contato com um ferimento na pele, é decomposto pela enzima catalase, liberando água e gás oxigênio, conforme reação a seguir.
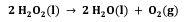
Considerando que 1,3 L de H2O2 (densidade = 1,00 g/mL) se decompõe a 40 °C e pressão de 1,0 atm, assinale a alternativa que apresenta o volume aproximado de gás oxigênio produzido.
Dados:
MM (H2O2) = 34 g/mol.
C = K (Kelvin) – 273
R = 0,082 L.atm/mol.K
(Disponível em: https://jovempan.com.br/noticias/brasil/gas-de-cozinha-atinge-maior-preco-em-2021-e-deve-ficar-ainda- mais-caro-entenda-o-reajuste-da-petrobras.html. Acessado em 28/09/2021)
Supondo que todo o GLP presente no botijão seja somente butano e está totalmente na forma líquida, e que o preço do botijão de gás seja de R$ 125,00, para uma família que teve um gasto mensal com a fatura de gás de R$ 55,77, qual a quantidade de energia que foi liberada, em quilojoules, na queima do gás butano?
A reação de combustão completa do butano (não balanceada):
C₄H₁₀(g) → CO₂ (g) + H₂O ∆H°C = 2.808 kJ/mol
A ureia ((NH2)2CO) é um composto orgânico, sólido, cristalino e solúvel em água. Ela tem diversas aplicações, como na alimentação de bovinos, estabilizador de explosivos, produção de resinas e medicamentos e até nas sínteses de fertilizantes agrícolas.
Um dos meios de se obter a ureia e água é pela reação entre gás carbônico e amônia, nas condições adequadas.
Com base no texto, é correto afirmar que:

Abaixo está representado um frasco contendo água e clorofórmio, dois líquidos imiscíveis.

A propriedade que explica o fato de o clorofórmio
corresponder a fase inferior e a água a fase superior
do sistema chama-se:
Disponível em:<https://www.campograndenews.com.br/cidades/interior/seis-cidades-de-ms-vao-ter-fluor-na-agua-encanada-a-partirde-agora >. Acesso em: 02 nov. 2021.
A fluoretação é utilizada no Brasil desde 1953. Atualmente o recomendado é 0,7 mg/L de fluoreto na água. Considerando que a fluoretação ocorre por meio da adição de fluoreto de sódio, podemos afirmar que a massa aproximada desse sal para fazer a fluoretação de 1 m3 de água é
Dados: Massas molares (g/mol) Na = 23; F = 19.
KClO3(s) → KCl(s) + 3/2O2(g)
Essa sua propriedade é frequentemente usada em laboratórios de ensino secundário e superior para produzir gás oxigênio. Nas CNTP, uma amostra de 136 g desse sal com pureza de 90%, em uma decomposição com rendimento de 80%, libera aproximadamente qual volume de gás?
Dados: KClO3 = 122,5u
Volume molar CNTP = 22,7 L
Adaptado.Produção de Alumínio: Extração da Bauxita, Obtenção na Eletrólise (culturalivre.com). (Acesso em 24 de Julho de 2021).
Podemos resumir a reação de obtenção do alumínio a partir do óxido de alumínio por meio da seguinte equação química balanceada. 2 Al2O3 (l) + 3 C(s) → 4 Al (l) + 3 CO2 (g) Dados: Massas atômicas (g/mol) Al=27; C=12; O=16. Assinale a alternativa que apresenta a massa, em gramas, de alumínio produzida se tivermos o triplo da quantidade, em mol, de óxido de alumínio e carvão.

