Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
Etapa I: CaCO3 (s) → CaO(s) + CO2(g)
Etapa II: CaO(s) + C(graf) → CaC2(s) + CO2(g)
Etapa III: CaC2(s) + H2O(l) → Ca(OH)2(aq) + C2 H2(g)
Partindo de uma amostra de 1260,0 g da calcita, com 12% de impurezas e um rendimento de 94%, o volume de acetileno produzido nas CNTP é:
(Dado, em g/mol: Ca = 40, C = 12, O = 16)
Na expressão 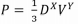 na qual P, D e V
representam pressão, densidade e velocidade,
respectivamente, os valores de X e Y, sendo a
expressão dimensionalmente correta, são os
seguintes:
na qual P, D e V
representam pressão, densidade e velocidade,
respectivamente, os valores de X e Y, sendo a
expressão dimensionalmente correta, são os
seguintes:
2 NO2 (g) → 2 NO (g) + O2 (g)
Em um experimento, realizou-se a reação de decomposição de 460 g de NO2 , obtendo-se 128 g de O2 . O rendimento desta reação foi de:
Dados: NO2 = 46 g/mol O2 = 32 g/mol
CaCO3 (S) → CaO (S) + CO2 (g) ΔH° = 180 kJ/mol
O calor consumido na decomposição de 500 g de CaCO3 é igual a:
Dado: massa molar do CaCO3 = 100 g/mol
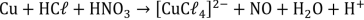
A soma dos menores coeficientes inteiros que balanceiam a equação é:
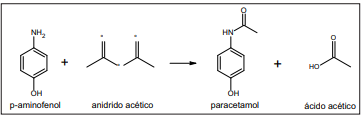
Sabendo que o rendimento dessa síntese é de 65%, o número de mols de paracetamol obtido a partir de 2,18 toneladas de p-aminofenol em excesso de anidrido acético é: (Dados: p-aminofenol = 109 g/mol; paracetamol = 151 g/mol)
Pode-se afirmar que na combustão de 52 g de ácido acético, há: (Dados em g/mol: C = 12, H = 1, O = 16)
Ao efetuar o balanceamento da reação acima, a soma dos menores coeficientes inteiros da reação será:
Considerando a massa de gás cloro que foi liberada por um único cilindro, o valor aproximado da massa, em toneladas, de ácidos que foram produzidos quando em contato com os organismos vivos equivale a: (Dados, em g/mol: H=1, O=16, Cl=35,5)
NH4NO3 (s) → N2O(g) + H2O(g) 1ª etapa N2O → N2(g)+ O2(g) 2ª etapa
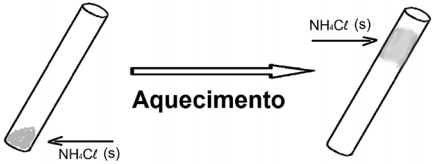
Com base nas observações do experimento, é CORRETO concluir que, nas condições em que o experimento foi realizado, o NH4 Cl
a I2 O5 (s) + b CO(g) ⥨ c I2 (g) + d CO2 (g) e I2 (aq) + f S2 O3 2-(aq) ⥨ g I- (aq) + h S4 O6 2-(aq)
Após balanceadas as equações, é CORRETO afirmar sobre os coeficientes de balanceamento que
O problema se deu pelo cálculo errado da quantidade de combustível, devido à recente substituição do sistema imperial pelo sistema métrico. O avião seria considerado corretamente abastecido, caso a massa total de combustível fosse 22300 kg, mas apenas recebeu um total de 22300 libras, menos da metade.
Considerando que o Avião já continha 7712 litros de combustível e que deveria ter um total de 22300 kg de combustível, quantos litros de combustível o avião deveria ter recebido no abastecimento? (Densidade do combustível = 0,800 kg L-1)
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
A estequiometria correta da equação química apresentada é obtida com os seguintes valores para x, y e z, respectivamente: 6, 2 e 3.
A respeito das propriedades da água, julgue os item que se segue.
A água tem seu volume reduzido e sua densidade
aumentada continuamente quando a temperatura é reduzida
de 25 ºC a 0 ºC.