Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.450 questões
Na + H2O → NaOH + H2
No balanceamento dessa reação, tem-se molécula(s) de sódio e de água que resulta(m) em hidróxido de sódio e hidrogênio molecular na respectiva proporção de
N2 + H2 → NH3
Após o balanceamento da reação, qual será o volume de amônia produzido, sabendo que 1 mol de gás produz volume de 22,4 L?
A respiração aeróbica é o processo de produção de energia por meio de carboidratos, conforme a seguinte reação:
C6H12O6 + 6 O2 + 6 H2O → 6 CO2 + 12 H2O
No consumo de duas moléculas de carboidrato, quantos mols de gás carbônico são liberados?
Observe a reação.
Fe2O3 + CO → Fe + CO2
Considerando essa reação não balanceada, quantos gramas de óxido de ferro (Fe2O3) são necessários para a produção de 4 mols de ferro (Fe) em uma reação balanceada?
Dados:
Massa molecular (Fe2O3) = 160 g/mol;
massa molecular (Fe) = 56 g/mol
Observe a figura que representa as informações sobre o elemento químico sódio, presente na tabela periódica.
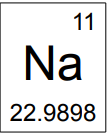
Os números apresentados acima e abaixo do símbolo do
sódio são, respectivamente:


Sobre esse experimento e os resultados observados, é CORRETO afirmar que no
2 Al(s) + 2 KOH(aq) + 6 H2O(l) → 2 KAl(OH)4(aq) + 3 H2(g) (etapa 1)
2 KAl(OH)4(aq)+ H2SO4(aq) → 2 Al(OH)3(s) + 2 H2O(l) + K2SO4(aq) (etapa 2)
2 Al(OH)3(s)+3 H2SO4(aq)+K2SO4(aq) → 2 KAl(SO4)2(s) + 6 H2O(l) (etapa 3)
a Al(s)+b KOH(aq)+c H2SO4(aq) →d KAl(SO4)2(s)+e H2O(l)+f H2(g) (reação total)
Após realizar o balanceamento da equação da reação total, assinale a alternativa que indica o somatório dos índices (a+b+c+d+e+f).
MgO(s) + 2 HCl(aq) → MgCl2(aq) + H2O(l)
Calcule a massa de óxido de magnésio necessária para neutralizar 0,06 mol de ácido clorídrico contido no estômago de uma pessoa.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Cl = 35,5; Mg = 24,3.
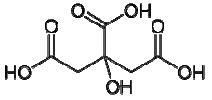
três afirmações foram feitas:
1) A molécula do ácido cítrico apresenta três carbonos com hibridização sp2 .
2) O citrato de sódio é um composto iônico com fórmula química C6H5Na3O7.
3) O fosfato de cálcio tem fórmula Ca2(PO4)3.
Está(ão) correta(s) a(s) afirmativa(s):
x C15H10O7(s) + y O2(g) → z CO2(g) + w H2O(g).
Após balancear a referida equação com os menores números inteiros possíveis, a soma dos coeficientes estequiométricos é:
Nessas condições, qual é o percentual aproximado de ferro no minério obtido?
O processo denominado de Hall-Héroult, que se constitui na eletrólise ígnea da alumina fundida (Al2 O3 ) na criolita (Na3 AlF6 ), foi patenteado por Charles M. Hall para a obtenção industrial alumínio puro.
A equação química total:
4Al+3(fundido) + 3C(grafita) + 6O–2(fundido) → 4Al(l) + 3CO2 (g)
Calcule, respectivamente, as quantidades de grafita consumida e a massa de CO2 (g) formado quando da produção de 2.700,0 kg de alumínio.
O acumulador de Chumbo, também conhecido como bateria chumbo-ácido, é utilizado nos automóveis com objetivo de fornecer corrente elétrica para iniciar a ignição do motor e também para a iluminação.
A reação total pode ser representada pela equação:
αPb(s) + βPbO2 (s) + γH2 SO4 (aq) → ψPbSO4 (s) + ωH2 O(l)
Balanceie a equação esquemática e responda às seguintes questões:
1. a sequência correta dos coeficientes estequiométricos α, β, γ, ψ e ω.
2. agente oxidante.
3. agente redutor.
Assinale a alternativa que responde corretamente às questões numeradas.
Para a reação abaixo:
αCr3+(aq) + βMnO2 (s) + γOH– → ρMn2+(aq) + ψCrO4 2–(aq) + ωH2 O(l)
Balanceie a equação esquemática e assinale a alternativa que indica a sequência correta dos coeficientes estequiométricos α, β, γ, ρ, ψ e ω
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Suponha‐se que uma amostra de carbonato de cálcio de
massa igual a 100 g seja aquecida até ser decomposta.
Nesse caso, considerando‐se a massa molar do carbono
igual a 12 g mol−1, a massa molar do oxigênio igual a 16
g mol−1 e a massa molar do cálcio igual a 40 g mol−1, a
massa residual de sólido obtido será menor que 46 g.