Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
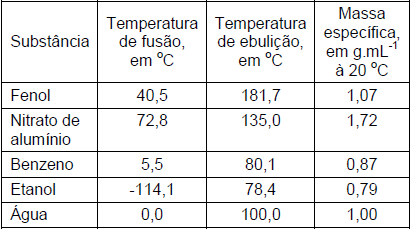
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
Texto para a questão.
A exploração, em sala de aula, do tema sabões e detergentes permite diferentes enfoques e técnicas de ensino, que promovem o pensamento crítico dos alunos por se tratar de um tema organizador relacionado a seu cotidiano. Tal proposta valoriza o aluno como indivíduo pensante, promovendo o papel do professor a mediador e orientador do processo educacional. Isso valoriza o papel desempenhado pela escola e contribui com o processo de aprendizagem da química, favorecendo, encorajando e sustentando a autoconstrução e o desenvolvimento do conhecimento por parte dos alunos. Nesse contexto, a equação genérica seguinte descreve o processo de saponificação, em que R corresponde a cadeias iguais ou diferentes, contendo entre 12 e 18 átomos de carbono.

Com base nesse caso hipotético, assinale a alternativa que apresenta o valor mais próximo da massa de NaOH necessária para essa reação.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
Um Profissional Técnico de Laboratório precisava determinar o teor de cinzas de uma amostra de biodiesel e seguiu uma metodologia descrita por Araújo et al, 2008. Para isso, ele utilizou cadinhos previamente tarados via aquecimento em mufla e pesagem. Nos cadinhos foram adicionados uma determinada quantidade de biodiesel. A seguir, a amostra foi submetida a aquecimento até a temperatura de combustão e após a queima foi aquecida a uma temperatura de 800°C por 2 horas. Em seguida foi adicionada uma solução aquosa de ácido sulfúrico (1:1) e a amostra foi novamente submetida ao processo de aquecimento (800°C por 2 horas). O Profissional Técnico aguardou o resfriamento e efetuou a pesagem dos cadinhos. O procedimento de aquecimento foi repetido até observação de peso constante.
ARAÚJO, A. M. M.; EVANGELISTA, J. P. C.; GOMES, A. F.; SOUZA, L. D.; MATIAS, L.G. O. Análises das cinzas sulfatadas do biodiesel produzido a partir da matéria-prima extraída do RN. In: 48º Congresso Brasileiro de Química – Química na Proteção ao Meio Ambiente e à Saúde. Rio de Janeiro, 2008.
Acerca da situação hipotética descrita acima,
assinale a alternativa correta.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
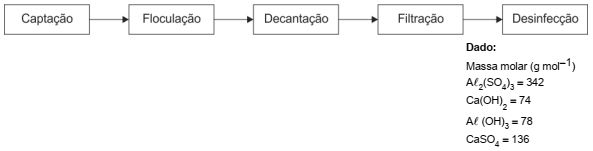
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
Alguns ácidos do elemento enxofre são: ácido sulfuroso, ácido tiossulfúrico, ácido sulfídrico e ácido sulfúrico.
As fórmulas químicas desses ácidos estão, respectivamente, apresentadas em:
