Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
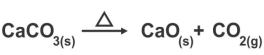
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?
Cloridrato de metformina é um medicamento usado para tratamento de diabéticos e sua fórmula está representada a seguir.
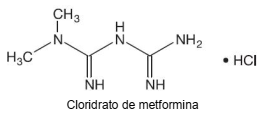
Dado:
Constante de Avogadro = 6,0 × 1023 mol−1
Quando o paciente ingere um comprimido com 500 mg desse medicamento, o número de moléculas dessa substância que entra
em seu corpo é de
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
Um Profissional Técnico de Laboratório precisava determinar o teor de cinzas de uma amostra de biodiesel e seguiu uma metodologia descrita por Araújo et al, 2008. Para isso, ele utilizou cadinhos previamente tarados via aquecimento em mufla e pesagem. Nos cadinhos foram adicionados uma determinada quantidade de biodiesel. A seguir, a amostra foi submetida a aquecimento até a temperatura de combustão e após a queima foi aquecida a uma temperatura de 800°C por 2 horas. Em seguida foi adicionada uma solução aquosa de ácido sulfúrico (1:1) e a amostra foi novamente submetida ao processo de aquecimento (800°C por 2 horas). O Profissional Técnico aguardou o resfriamento e efetuou a pesagem dos cadinhos. O procedimento de aquecimento foi repetido até observação de peso constante.
ARAÚJO, A. M. M.; EVANGELISTA, J. P. C.; GOMES, A. F.; SOUZA, L. D.; MATIAS, L.G. O. Análises das cinzas sulfatadas do biodiesel produzido a partir da matéria-prima extraída do RN. In: 48º Congresso Brasileiro de Química – Química na Proteção ao Meio Ambiente e à Saúde. Rio de Janeiro, 2008.
Acerca da situação hipotética descrita acima,
assinale a alternativa correta.
Em uma determinação de cálcio por fotometria de chama, uma amostra de água mineral foi diretamente analisada, sendo obtido o teor de cálcio igual a 15,81 mg.L–1 . A mesma amostra foi, posteriormente, contaminada com lantânio a 1% e então submetida à análise nas mesmas condições. O teor de cálcio obtido na segunda determinação foi 58,97 mg.L–1 .
O teor de cálcio na amostra foi de
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
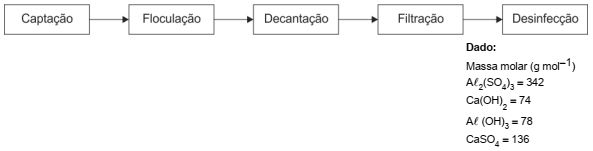
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
