Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato
de potássio e o cátion do nitrato de alumínio é maior que
250,0 g/mol.
Em uma reação de adição, do tipo A + B ↔ 2C, determine a velocidade da reação inversa, sabendo que a determinada temperatura a constante de equilíbrio da reação é 5,0 104, para [B] = 1,0 10-5 mol/L, [C] 4,0 10-3 mol/L e a constante de velocidade da reação direta igual a 2,0 10-6(mol/L s)-1.
Sobre a química de coordenação e estruturas eletrônicas, assinale apenas a alternativa CORRETA.
Entre os compostos apresentados abaixo, o que reage com NaOH sob aquecimento, produzindo acetato de sódio e isopropanol, é
Considere que 1,0 mg de fosfato de potássio, com 90% de pureza, reagiu completamente com 100,0 mL de uma solução aquosa de ácido sulfúrico. Assim, a normalidade da solução do ácido será aproximadamente
Dados: Massas molares (g mol-1): H = 1; O = 16; S = 32; P = 31; K = 39
A ustulação é um processo químico utilizado na metalurgia, que consiste em aquecer um sulfeto na presença de gás oxigênio. A ustulação completa da pirita está representada pela equação química abaixo:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2.
Ao submeter a esse processo 200 toneladas de pirita com 80% de pureza, o volume de SO2 obtido nas CNTP, expresso em m3 , será aproximadamente
Dados: Massas molares (g mol-1): O = 16; S = 32; Fe = 56
Considere que 125,0 g de um determinado ácido no estado sólido neutralizam completamente 2,5 L de uma solução aquosa 0,25 mol L-1 de hidróxido de bário. Nessas condições, a massa de um equivalente-grama do ácido é
Se 30,0 mL de uma solução 0,1 mol L-1 de KMnO4 foram reduzidos em meio ácido por 15 mL de outra solução, então, a normalidade da solução redutora é igual a
Uma amostra de calcário (CaCO3) pesando 1,5 g foi tratada com 50,0 mL de uma solução aquosa 0,25 mol L-1 de ácido clorídrico. A solução resultante foi cuidadosamente fervida para a eliminação total do CO2, bem como do excesso de ácido titulado por 3,0 mL de uma solução aquosa M/6 de NaOH. Assim, a pureza do calcário analisado, expressa em termos do porcentual de CaO e de CaCO3, é, respectivamente,
Dados: Massas molares (g mol-1): C = 12; O = 16; Ca = 40
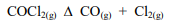
A decomposição do fosgênio é intensificada se:
Qual o potencial no ponto de equivalência.