Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
Zn + 2HC1 → ZnCl2 + H2
Dado: MM CuCl = 99 g.mol-1
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
Após analisar as afirmativas de I a V, assinale a alternativa correta:
Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
6NH4 ClO4 (s) + 10Al (s) → 5Al2 O3 (s) + 3N2 (g) + 6HCl (g) + 9H2O (g)
Considerando que se colocou para reagir 1 kg do perclorato de amônio com 1 kg do alumínio, quanto, aproximadamente, de massa, em gramas, do óxido foi produzido na reação?
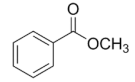 Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é:
Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é:Análises químicas mostraram que um lote de carvão específico contém 2% de enxofre em massa. Quando esse carvão é queimado, o enxofre é convertido em gás dióxido de enxofre.
Considerando que nesse processo todo o dióxido de enxofre produzido da queima do carvão reagiu completamente com óxido de cálcio produzindo 2 mil toneladas de sulfito de cálcio, é correto afirmar que a massa aproximada, em toneladas, de carvão queimado é:
Analise as seguintes reações de oxirredução:
I. _ H2 S(g) + _ SO2 (g) → _ S(s) + _ H2 O(l)
II. _ B2 O3 + _ Mg(s) → _ B(s) + _ MgO(s)
A alternativa que representa as equações balanceadas é:
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 . Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
A fórmula estrutural de um hidrocarboneto é representada
a seguir:
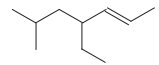
Este hidrocarboneto é nomeado
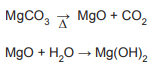
A massa de Mg(OH)2 obtida a partir de uma massa inicial de MgCO3 igual a 2,1 g é
Dados M(Mg) = 24,3 g mol-1 M(C) = 12,0 g mol-1 M(O) = 16,0 g mol-1 M(H) = 1,0 g mol-1


