Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.450 questões
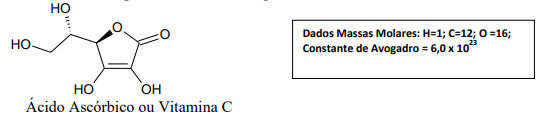
Assinale a alternativa que apresenta corretamente a quantidade de matéria, em mols, e a quantidade de oxigênio, em miligramas, presentes em 440 mg de ácido ascórbico.
Qual a massa de CO2, em gramas, produzida na combustão completa de 370 mg de varfarina?
Dado: massa molecular da varfarina = 308 g mol-1 massa molecular do CO2 = 44 g mol-1
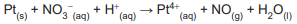
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
SO3(g) +H2SO4(l) → H2 S2 O7(l) (Equação1) H2S2O7(l) + H2O(l) → 2H2 SO4(l) (Equação2)
CAMPOS, R. V. Ácico Sulfúrico. Rev. Virtual Quim. 2011, 3(3), 210-214 (adaptado).
Para a produção do ácido sulfúrico 98% m/m, a indústria partiu de 800kg de SO3 e 980kg de H2SO4, além de água o suficiente para obtenção desse produto. A massa de ácido sulfúrico 98% m/m que se pode obter, em kg, é
Dados: Massa molar: O=16g/mol; H=1g/mol; S=32g/mol
Dados: MMFe = 56 g mol-1 MMO = 16 g mol-1
UO2 + 4 HF → UF4 + 2 H2O
Uma amostra de 900 g de UO2 impuro reagiu com excesso de HF, formando 942 g de UF4 . Admitindo-se que as impurezas não participaram da reação, o grau de pureza da amostra é igual a

O processo de obtenção consiste na calcinação da mistura de sílica (SiO2) com carbonato de sódio (Na2CO3), produzindo o silicato de sódio e gás carbônico. Este processo apresenta rendimento de 70%.
A massa de silicato de sódio que poderá ser obtida por este processo, a partir de 3,0 kg de sílica, é: Dados: Massas molares em g.mol–1 Si = 28; O = 16; Na = 23; C = 12.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
O oxigênio representa aproximadamente 20% (em volume) do ar atmosférico em relação aos outros gases presentes na mistura. Quando o oxigênio e o monóxido de carbono se encontram, ocorre a seguinte reação química.
CO (g) + ½ O2 (g) → CO2 (g)
Nessa situação, considerando que todos os gases estejam submetidos à mesma pressão e temperatura, o volume de ar necessário para a combustão completa de 20 L de monóxido de carbono é
A respeito das propriedades gerais de sólidos, líquidos e soluções, julgue o item.
A massa molar pode ser definida como a massa por mol
de átomos de um elemento, a massa por mol de
moléculas de um composto molecular ou a massa por
mol de fórmulas unitárias de um composto iônico.

Uma amostra de água que contenha 1,0 × 10−7 mol/L de benzeno está apta para consumo, conforme a legislação brasileira.
Acerca de estequiometria, julgue o item que se segue.
As bases fundamentais da estequiometria são a lei das
proporções definidas, a lei das proporções múltiplas e a lei
das proporções equivalentes.
Acerca de estequiometria, julgue o item que se segue.
Em uma reação química, o reagente limitante serve de base
para o cálculo do rendimento teórico.
Considerando-se que os óxidos são compostos inorgânicos com diversas aplicações na indústria química, julgue o item subsequente.
O químico francês Joseph Proust elaborou a lei da
conservação das massas.
A partir desses dados, a perita conseguiu determinar a fórmula empírica como sendo:
Por exemplo, pode-se produzir 448cm3 de H2 nas CNTP reagindo alumínio (peso molecular de 27g) com excesso de uma solução aquosa de HCl, desde que seja usada a seguinte quantidade de átomos de alumínio:
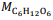 = 180 g/mol e
= 180 g/mol e 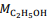 = 46 g/mol.
= 46 g/mol. De acordo com a reação descrita, para a obtenção de 1,0 kg de etanol, são necessários mais de 2,0 kg de glicose.
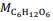 = 180 g/mol e
= 180 g/mol e 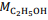 = 46 g/mol.
= 46 g/mol. De acordo com a lei de Lavoisier, na reação de fermentação da glicose para produzir somente etanol e gás carbônico, em recipiente fechado, a massa de glicose consumida é igual à massa de etanol produzida, que é igual à massa de CO2 liberada.
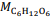 = 180 g/mol e
= 180 g/mol e 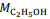 = 46 g/mol.
= 46 g/mol. A química distanciou-se da alquimia a partir dos ensaios de Robert Boyle, um dos primeiros pesquisadores a dar forma científica ao atomismo, opondo-se a Aristóteles e Paracelso.