Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
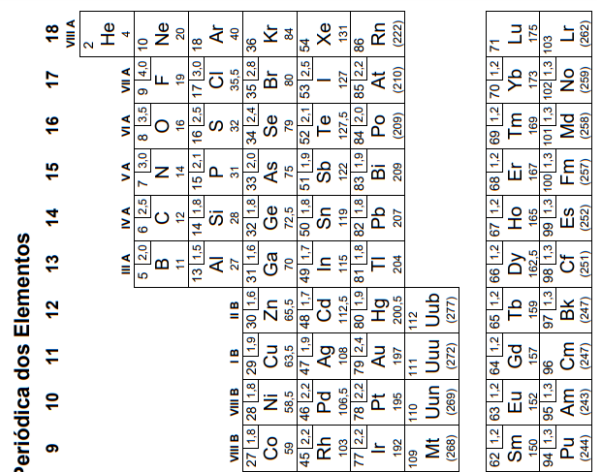
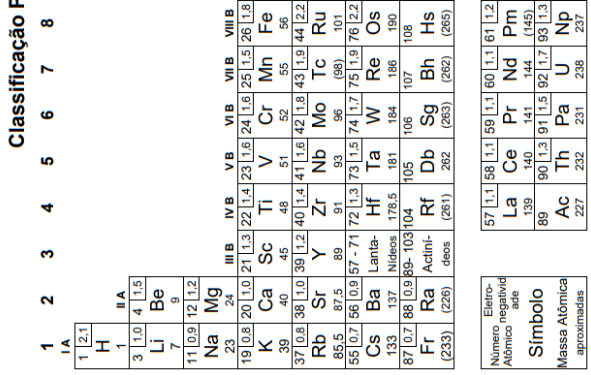
O elemento X é o


4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
A respeito de conceitos de química orgânica, julgue o próximo item.
O estado estequiométrico é atingido, em uma reação química, quando as concentrações de reagentes e produtos não se alteram
mais.
O número de átomos de carbono presentes na fórmula molecular do flurbiprofeno é igual a
• 2KClO3 (s) → 2 KCl (s) + 3 O2 (g) • 2 KHCO3 (s) → K2O (s) + H2O (g) + 2 CO2 (g) • K2CO3 (s) → K2O (s) + CO2 (g)
Nas condições reacionais empregadas, o rendimento foi de 100% e produziu 1,80 g de água, 19,2 g de gás oxigênio e 22,0 g de gás carbônico.
Os percentuais aproximados de KClO3, KHCO3 e K2CO3 na amostra inicial são, respectivamente, iguais a
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a
Em uma reação de neutralização, o reagente consumido em primeiro lugar é chamado de reagente limitante. A quantidade mínima de produto que pode ser formada depende da quantidade inicial desse reagente; o reagente presente em quantidade superior à necessária para reagir é chamado de reagente em excesso. Esse tipo de reagente em quantidade superior é totalmente utilizado pela reação, de modo que é inteiramente consumido.
A abordagem das reações químicas em solução pode ser realizada de modo quantitativo; no entanto, em razão da interpretação das equações químicas em termos de relações quantitativas, os cálculos estequiométricos impedem a previsão das quantidades de reagentes e produtos nas reações químicas.
A Lei das Proporções Definidas é também conhecida como Lei de Proust. Esse estudioso observou que amostras de compostos diferentes, de massas iguais, contêm sempre a mesma proporção em massa dos seus elementos constituintes. Desse modo, as proporções em massa dos elementos constituintes são fixas para quaisquer compostos distintos.
A Lei da Conservação das Massas, ou Lei da Conservação da Matéria, é observada e difundida no meio científico pela realização de experimentos em recipientes fechados e com balanças precisas; a soma das massas antes de uma reação é igual à soma das massas após a reação.
É consenso entre os estudiosos da área que o início da química como área de conhecimento deu-se com o trabalho de Robert Boyle (1627-1691), considerado o “pai” da química.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Assumindo-se que todo o monóxido de carbono
foi consumido na conversão da hematita para o ferro
e que essa reação foi completa e sabendo-se que
MFe = 56 g/mol e M(Fe2O3) = 160 g/mol, é correto
concluir que a quantidade, em gramas (g), de ferro
obtida a partir de 0,48 kg de Fe2O3 é superior a 400.
Com base nessa situação e considerando-se
 a massa molar da cafeína e
a massa molar da cafeína e  a constante de Avogadro, é correto concluir
que o número de moléculas de cafeína ingeridas pelo britânico é
a constante de Avogadro, é correto concluir
que o número de moléculas de cafeína ingeridas pelo britânico é Massas Molares em g/mol: C=12,011; O=16,000; Ca=40,01; Dados: R = 0,082 L.atm/mol.K; T(k) = t(°C) + 273
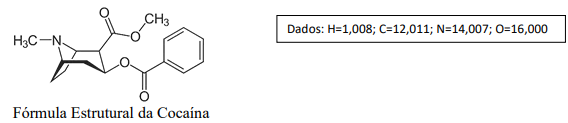
Supondo que a Polícia Federal fez uma apreensão e a amostra de cocaína pura foi analisada por combustão, a porcentagem aproximada de átomos de carbono, hidrogênio, nitrogênio e oxigênio, respectivamente, na molécula da cocaína, é:
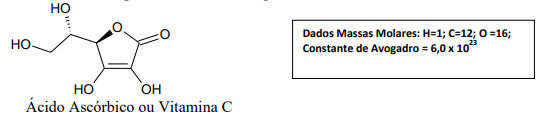
Assinale a alternativa que apresenta corretamente a quantidade de matéria, em mols, e a quantidade de oxigênio, em miligramas, presentes em 440 mg de ácido ascórbico.
Qual a massa de CO2, em gramas, produzida na combustão completa de 370 mg de varfarina?
Dado: massa molecular da varfarina = 308 g mol-1 massa molecular do CO2 = 44 g mol-1
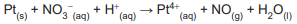
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
SO3(g) +H2SO4(l) → H2 S2 O7(l) (Equação1) H2S2O7(l) + H2O(l) → 2H2 SO4(l) (Equação2)
CAMPOS, R. V. Ácico Sulfúrico. Rev. Virtual Quim. 2011, 3(3), 210-214 (adaptado).
Para a produção do ácido sulfúrico 98% m/m, a indústria partiu de 800kg de SO3 e 980kg de H2SO4, além de água o suficiente para obtenção desse produto. A massa de ácido sulfúrico 98% m/m que se pode obter, em kg, é
Dados: Massa molar: O=16g/mol; H=1g/mol; S=32g/mol
Dados: MMFe = 56 g mol-1 MMO = 16 g mol-1