Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.439 questões
Considere as afirmativas abaixo e depois responda:
I. Para o preparo de uma solução a 10% de cloreto de sódio (NaCl) em água é necessário dissolver exatos 10g de NaCl em exatos 100 mL de água;
II. Uma solução 1N de NaCl pode ser preparada pela dissolução de 1 equivalente-grama de NaCl em 100 mL de solução;
III. Uma solução 5 Molar de NaCl deve conter 5 moles do soluto em 100 do solvente.
PCl3 + H2O → H3PO3 + HCl
85,5 g de sacarose (C12H22O11) são dissolvidos em 180 g de água. A fração molar da solução é igual a
Dados: H = 1u; C = 12 u; O = 16 u.
O carbonato de cálcio reage com o ácido bromídrico produzindo brometo de cálcio de acordo com a reação apresentada abaixo:
CaCO3 + HBr → CaBr2 + H2O + CO2
Indique a massa, em gramas, de brometo de cálcio obtida quando 20 g de carbonato reagem com 15 g de ácido bromídrico. Considere que Ca = 40 u; C = 12 u; O = 16 u; H = 1u e Br = 80u.
Cr2O72-(aq) + 6Fe2+(aq) + 14H+(aq) -› 2Cr3+(aq) + 6Fe3+(aq) + 7H2O(l)
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1 que reage com 0,5 mol de NaOH é:
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação:
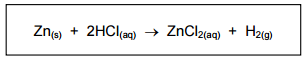
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
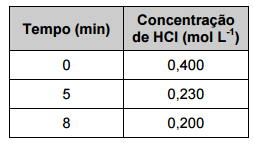
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1
) no intervalo de 5 a
8 minutos é
Durante um procedimento de preparação de soluções no laboratório de alimentos, o analista precisa pesar a massa necessária para preparar as soluções abaixo descritas: (Dados: H=1; Na=23; C=12; O=16).
I - 500 mL de uma solução de concentração 0,02 N de carbonato de sódio (Na2CO3), que será utilizada para a padronização de soluções;
II - 1 litro de solução de ácido acético (C2H4O2) 0,025 M, que será usada para a titulação
de soluções.
As massas que devem ser pesadas para a preparação das soluções I e II, respectivamente ,
são: