Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
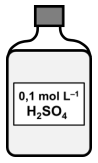
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
1 N2 (g) + 3 H2 (g) → 2 NH3 (g)
Dados: Massa Molar (N2 ) = 28 kg/kmol; Massa Molar (H2 ) = 2 kg/kmol. A vazão mássica de N2 na alimentação para produção de 1700 kg/dia de amônia é
Assinale a alternativa que apresenta nomenclaturas CORRETAS dos seguintes compostos:
I – Bicarbonato de sódio
II – Nitrato de potássio
III – Hidróxido de alumínio
IV – Ácido hipocloroso
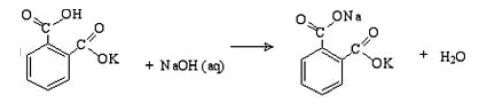 Na padronização de uma solução de NaOH um assistente de laboratório pesou uma massa de
0,5 g de hidrogenoftalato de potássio e gastou na titulação 25,0 mL de uma solução de NaOH de
concentração desconhecida. Qual é a concentração aproximada do NaOH em mol/L?
Na padronização de uma solução de NaOH um assistente de laboratório pesou uma massa de
0,5 g de hidrogenoftalato de potássio e gastou na titulação 25,0 mL de uma solução de NaOH de
concentração desconhecida. Qual é a concentração aproximada do NaOH em mol/L?
Dados: Massa molar do hidrogenoftalato de potássio: 204,2 g/mol; Massa molar do hidróxido de sódio: 40,0 g/mol
O íon potássio em 250,0 mL de uma amostra de água mineral foi precipitado com tetrafenilborato de sódio:
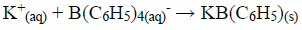
O precipitado foi filtrado, lavado e redissolvido em um solvente orgânico. Um excesso de quelato EDTA/mercúrio(II) foi adicionado:
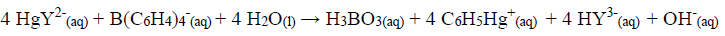
O EDTA liberado foi titulado com 30,00 mL de Mg2+ 0,0550 mol L-1.
(Dado: K = 39 g mol-1, Mg = 24 g mol-1)
Após a análise, a concentração aproximada do íon potássio em partes por milhão será:
Defensivos agrícolas são intensamente usados na proteção das plantações. A concentração do produto aplicado prescrita por agrônomos depende da pureza do produto. O Captan (C9H8O2Cl3NS) é um fungicida especialmente eficiente contra a praga de ferrugem. Na sua forma pura é uma substância cristalina branca, com ponto de fusão de 175°C, pouco solúvel em água. Um produto de grau técnico, de cor acinzentada, com ponto de fusão de 164°C, foi levado a um laboratório químico para análise. Uma amostra de 0,5500 g foi pesada e corretamente manipulada para se proceder a hidrólise e subsequente liberação dos íons cloreto e da tetrahidroftalimida (C8H9NO2). A seguir foi cuidadosamente tratada com 50,00 mL de uma solução padrão de AgNO3 0,1000 mol L-1. O excesso destes íons Ag+ foi titulado com outra solução padrão de KSCN 0,0500 mol L -1, gastando-se 10,00 mL até atingir o ponto final da titulação, utilizando como indicador uma pequena quantidade de íons Fe3+.
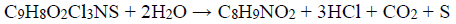
Dados: C9H8O2Cl3NS; 300,5 g mol-1 , C8H9NO2;151 g mol-1
Com base nas informações fornecidas pelo problema é CORRETO afirmar:
Julgue o item subsequente, relativo a soluções.
Considere que a solubilidade do sal de cozinha (NaCl) em
água, a temperatura ambiente (de 20 ºC) e pressão atmosférica
normal (de 1 atm ao nível do mar) seja igual a 0,36. Nesse
caso, é impossível dissolver 500 g de sal em 1 L de água,
mesmo que se aqueça a solução.
Observe a equação da reação química a seguir, onde A, B e C são valores de coeficientes da equação:
AFe + B0₂ →CFe₂0₃
Caso seja feito o balanceamento da equação, os valores corretos dos coeficientes A, B e C serão: