Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
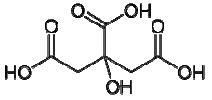
três afirmações foram feitas:
1) A molécula do ácido cítrico apresenta três carbonos com hibridização sp2 .
2) O citrato de sódio é um composto iônico com fórmula química C6H5Na3O7.
3) O fosfato de cálcio tem fórmula Ca2(PO4)3.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: C = 12; H = 1; S = 32; O = 16
Fe2 (SO4 )3 + Cr2 (SO4 )3 + K2SO4 + H2O → K2Cr2O7 + H2SO4 + FeSO4
Na combustão da gasolina comum, um de seus componentes − o isooctano é padrão para a qualidade da gasolina. Quanto maior é o índice de octanagem, maior é a compressão que a mistura gasolina-ar suporta no motor, sem detonação prematura; portanto, melhor é a qualidade da gasolina.
A fórmula molecular do isooctano é C8H18. A gasolina pode sofrer combustão completa produzindo CO2 e água ou incompleta − produzindo CO e água ou C (fuligem) e água. Isso ocorre de acordo com a quantidade de oxigênio: combustões completas ocorrem com quantidade de oxigênio suficiente para consumir todo combustível. Por outro lado, a combustão se dá de forma incompleta quando não houver oxigênio suficiente para consumir todo o combustível.
Dada a reação não balanceada a seguir:
r Fe2+ + s Cr2O72− + t H+ → u Fe3+ + v Cr3+ + w H2O
Completa r, s, t, u, v e w, correta e respectivamente, os coeficientes
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
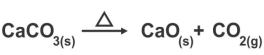
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
Cloridrato de metformina é um medicamento usado para tratamento de diabéticos e sua fórmula está representada a seguir.
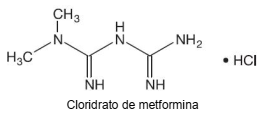
Dado:
Constante de Avogadro = 6,0 × 1023 mol−1
Quando o paciente ingere um comprimido com 500 mg desse medicamento, o número de moléculas dessa substância que entra
em seu corpo é de
Em uma determinação de cálcio por fotometria de chama, uma amostra de água mineral foi diretamente analisada, sendo obtido o teor de cálcio igual a 15,81 mg.L–1 . A mesma amostra foi, posteriormente, contaminada com lantânio a 1% e então submetida à análise nas mesmas condições. O teor de cálcio obtido na segunda determinação foi 58,97 mg.L–1 .
O teor de cálcio na amostra foi de
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Um frasco de ácido clorídrico concentrado contém 37% de HCl em massa e apresenta uma densidade de 1,20 g mL-1 . Foi transferido 5,00 mL de HCl desse frasco para um balão volumétrico de um litro e avolumado com água deionizada.
Qual o volume necessário dessa solução de HCl diluída para neutralizar 500 mL de NaOH 0,02 mol L-1 ?
O ácido oxálico (H2C2O4 . 2H2O) é um ácido diprótico muito usado para fins analíticos, industriais e aplicações veterinárias. Uma amostra de 0,2520 g de um ácido oxálico foi pesada e titulada completamente com 25,00 mL de uma solução de NaOH de concentração 0,1200 mol L-1 .
Dado: H2C2O4 . 2H2O = 126 g mol-1
A porcentagem de pureza desse ácido é:
Uma das formas de produção da amônia é a partir da reação entre a cal viva (óxido de cálcio) e o cloreto de amônio, conforme reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10 g de uma amostra de cal viva foram colocados para reagir com excesso de cloreto de amônio e foram produzidos 5 g de amônia. Qual a porcentagem de óxido de cálcio dessa amostra de cal viva?
Dados: CaO (56 g mol-1 )
NH4Cl (53,5 g mol-1 )
NH3 (17 g mol-1 )
H2O (18 g mol-1 )
CaCl2 (111 g mol-1
)