Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.463 questões
A exploração de minério de ferro no Estado do Pará concentra-se principalmente na região Sudeste do Estado, mais especificamente na Serra dos Carajás. Uma amostra de solo daquela região pesando 0,50 g, contendo Fe-II e Fe-III, foi tratada, oxidando-se todo o ferro contido à Fe-III. Após tratamento adequado, foi solubilizado e precipitado com solução alcalina amoniacal como hidróxido de ferro III. O precipitado depois de filtrado, lavado e calcinado, foi obtido o óxido correspondente que pesou 0,25 g. O teor de ferro encontrado na amostra de solo foi de:
Dados Massa Atômicas em g/mol: Fe= 56 O= 16 H= 1
O etilenoglicol (C2H6O2) é um álcool muito utilizado como anticongelante automotivo. Adicionado à água, ele atrai fortemente suas moléculas. Isso acontece porque o etilenoglicol é capaz de fazer pontes de hidrogênio com a água, o que resulta em um abaixamento da temperatura de congelamento. Pode-se dizer que a interação dos dois dificulta a "organização" para a formação de um sólido, que resulta em um ponto de congelamento menor que o das duas substâncias separadas. Diante do que foi exposto, qual o ponto de congelamento de uma solução que contém 250g de etilenoglicol e 1350g de água. Dados: (Kc água = 1,86ºC Kg/mol; Metilenoglicol = 62,1g/mol).
Pressão de vapor é a pressão exercida por um vapor quando este está em equilíbrio termodinâmico com o líquido que lhe deu origem. A pressão de vapor de uma mistura é diferente da pressão de vapor do solvente puro. No caso de uma solução líquida com um soluto não-volátil, a pressão de vapor é sempre menor que a do solvente. Supondo que uma solução contém 20g de um soluto orgânico não volátil em 250g de álcool etílico tem uma pressão de vapor de 316,0 torr, a 25ºC. Se a pressão de vapor do álcool etílico puro é de 368,3 torr, nesta temperatura, qual será o número de mols do soluto? (Dados: Málcool etílico = 46,07g/mol)
A oxigenoterapia consiste no tratamento da hipóxia que é diminuição das taxas de oxigênio no sangue arterial ou nos tecidos. Esse tratamento consiste na inalação de oxigênio, a uma pressão maior que a do ar ambiente, o que facilita a troca gasosa e reduz o trabalho da respiração. (II Consenso Brasileiro de Ventilação Mecânica. J Pneumol 2000;26 (Suppl 2): S1-2.)
O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão. Supondo que o cilindro contém 200 cm3 de gás oxigênio (O2), submetido à temperatura constante de 150°C e pressão total de 1,0 atm. Assumindo que o O2 se comporta como gás ideal, assinale a opção CORRETA que apresenta os respectivos valores numéricos do número de moléculas e da massa específi ca, em kg m-3, desse gás quando exposto às condições de pressão e temperatura apresentadas. : (Dados: R=0,082 dm3 atm mol-1 K-1 Número de Avogadro 6,02x1023)
Os agentes sulfitantes são classif cados como aditivos alimentares e atuam na inibição da deterioração provocada por bactérias, fungos e leveduras em alimentos ácidos, e na inibição de reações de escurecimento enzimático e não enzimático, durante processamento e estocagem. No entanto, apesar da eficácia dos sulfitos na indústria alimentícia, inúmeros efeitos adversos à saúde humana têm sido relacionados à sua ingestão, principalmente, anafilaxia, urticária, angioedema, hipotensão, náusea, irritação gástrica local, diarréia e crise asmática em indivíduos asmáticos sensíveis a sulfitos. Na União Europeia, os sulf tos são considerados, a partir de 2005, como alergênicos, devendo obedecer ao limite máximo de 10mg/L. Uma vez ultrapassado este valor, é obrigatória a menção no rótulo. (http://www.sciencedirect.com/science/ article/pii/S0956566310003106.Adaptado)
Supondo que a produção anual de suco industrializado na União Europeia é de 450 milhões de litro por ano, a quantidade máxima de sulfitos, em quilogramas, que pode ser encontrada no volume considerado de suco industrializado, produzido durante um ano e que respeita o limite máximo de sulfito nessa bebida é:
Ao adicionar 4 mol de cloreto de sódio a uma solução aquosa que contêm 510 g de nitrato de prata. Podemos afirmar que: (Dados: massa molar em g/mol: Ag=108; Na=23; O=16; N=14; Cl=35,5.)
De acordo com o gráfico a seguir, escolha a alternativa CORRETA entre as afirmativas abaixo:
(Fonte: http://www2.chemistry.msu.edu/faculty/reusch/virttxtjml/physprop.htm)
I. A molécula de água (H2O) realiza ligações covalentes entre seus átomos e entre suas moléculas, por isso apresenta o ponto de ebulição mais elevado entre as substâncias mostradas no gráfico.
II. O fluoreto de hidrogênio (HF) apresenta maior ponto de ebulição que o cloreto de hidrogênio (HCl), pois entre suas moléculas são realizadas ligações iônicas (fortes), enquanto que entre as moléculas do HCl são realizadas ligações de pontes de hidrogênio (mais fracas).
III. O gráfico mostra que, conforme aumenta a massa molar das substâncias, aumenta a temperatura de ebulição das mesmas, com exceção às moléculas de H2O em relação a H2S e HF em relação HCl.
IV. Em temperatura ambiente (27 ºC), as substâncias químicas HCl e HBr são líquidas, pois realizam ligações de pontes de hidrogênio e de Van der Waals, respectivamente.
V. O gás metano (CH4) apresenta o menor ponto de ebulição entre todas as substâncias mostradas no gráfico, pois além de realizar ligações de Van der Waals intermoleculares também é a molécula de menor massa molar.
São CORRETAS apenas as afirmativas:
Qual a quantidade de hidróxido de sódio necessária para o preparo de 200 ml de uma solução aquosa na concentração de 40 g/L?
Uma central petroquímica utiliza carvão mineral como fonte de energia para a geração de vapor. O carvão utilizado contém, em média, 2% de seu peso de enxofre. A queima do carvão gera dióxido de enxofre, que será removido em um equipamento de remoção à base de dióxido de cálcio. A central petroquímica queima 3.000 toneladas de carvão por dia. Considerando a eficiência de conversão de 75%, qual a quantidade de dióxido de cálcio necessária para a remoção total do enxofre e a quantidade de sulfito de cálcio gerada diariamente, respectivamente?
Para o preparo de uma solução de Ácido Clorídrico (HCL) 1+1 (50%) deve-se, em um balão volumétrico de 1L, adicionar aproximadamente 400mL de água destilada e acrescentar, vagarosamente, um volume de ácido concentrado e completar o volume para 1L com água destilada. Para esta solução, qual deve ser o volume de ácido concentrado? Analise as afirmativas seguintes e marque a alternativa CORRETA:
I – O volume do ácido concentrado é de 500mL.
II – O volume do ácido concentrado é de 200mL.
III – O volume do ácido concentrado é de 100mL
IV - O volume do ácido concentrado é de 50mL.
a I2 O5 (s) + b CO(g) ⥨ c I2 (g) + d CO2 (g) e I2 (aq) + f S2 O3 2-(aq) ⥨ g I- (aq) + h S4 O6 2-(aq)
Após balanceadas as equações, é CORRETO afirmar sobre os coeficientes de balanceamento que
O problema se deu pelo cálculo errado da quantidade de combustível, devido à recente substituição do sistema imperial pelo sistema métrico. O avião seria considerado corretamente abastecido, caso a massa total de combustível fosse 22300 kg, mas apenas recebeu um total de 22300 libras, menos da metade.
Considerando que o Avião já continha 7712 litros de combustível e que deveria ter um total de 22300 kg de combustível, quantos litros de combustível o avião deveria ter recebido no abastecimento? (Densidade do combustível = 0,800 kg L-1)

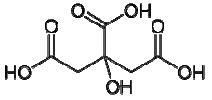
três afirmações foram feitas:
1) A molécula do ácido cítrico apresenta três carbonos com hibridização sp2 .
2) O citrato de sódio é um composto iônico com fórmula química C6H5Na3O7.
3) O fosfato de cálcio tem fórmula Ca2(PO4)3.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: C = 12; H = 1; S = 32; O = 16