Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
A adição da solução de MgEDTA é necessária para complexar
interferentes presentes na amostra e, assim, determinar
precisamente a quantidade de cálcio.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
Titulações de complexação com EDTA devem ser realizadas
com pH controlado, preferencialmente pH ácido, para evitar a
formação de hidróxidos dos metais de interesse.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
O teor de cálcio da referida amostra é superior a 3,0 g/L.
Nos anos de 1950, tanto os Estados Unidos quanto a antiga União Soviética tinham programas para usar o decaborano (B10H14) como combustível de foguete. Esse composto reage violentamente com oxigênio, de acordo com a equação química a seguir.
B10H14 + 11 O2 → 5 B2O3 + 7 H2O
Na tentativa de simular a eficiência máxima do foguete, considere que um engenheiro elaborou um projeto que consumiu o decaborano (B10H14) com 80% de pureza.
Sabendo que 10 mil kg do decaborano foram colocados para reagir com oxigênio, aproximadamente quantos mols de moléculas do B2O3 foram produzidos na reação?
Sobre alguns compostos moleculares, considere que um estudante faz as seguintes classificações:
I. Composto CO2 (forma geométrica linear e molécula apolar).
II. Composto H2S (forma geométrica angular e molécula polar).
III. Composto CH2O (forma geométrica tetraédrica e molécula polar).
Estão corretas as classificações:
Considere que no preparo de uma solução de HCl 0,1 mol/L um técnico utiliza 4,5 mL da solução de estoque do reagente concentrado. A solução de estoque tem as seguintes especificações:

Nessas condições, e para garantir uma concentração
mais próxima possível daquela que o técnico pretende,
é correto afirmar que o balão volumétrico utilizado para
o preparo dessa solução é de:
Considere que um técnico de laboratório busque maneiras de melhorar o processo pela qual o minério de ferro, contendo Fe2O3 , é convertido em ferro. Em seus testes, ele realizou a seguinte reação em pequena escala.
Fe2O3 (s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Nessas condições, admitindo que há 150 g de Fe2O3 como reagente limitante, qual é aproximadamente o rendimento teórico de ferro?
Considere que, em um experimento de química, um técnico misturou as soluções de três balões volumétricos em um único recipiente. Os balões tinham as seguintes especificações:
Balão A: 200 mL de NaOH 0,1 mol/L
Balão B: 100 mL de NaOH de concentração desconhecida
Balão C: 200 mL de NaOH 0,05 mol/L
Considerando o volume total da mistura é de 500 mL e que a mistura é totalmente consumida na reação química com 500 mL de ácido clorídrico (HCl) 0,1 mol/L, é correto afirmar que a concentração da solução de NaOH do balão B é igual a:
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
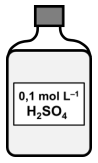
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?