Questões de Concurso
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 90 questões
I. Pb(NO3)2 (aq) + 2 KI (aq) ➔ 2 KNO3 (aq) + PbI2 (s)
II. A molaridade dos íons Pb2+(aq) e I – (aq) após a mistura continua a ser de 0,2 M.
III. Não haverá precipitação de PbI2 após a mistura.
Está CORRETO o que se afirma em
Água “dura” contém aproximadamente 2.10-3 mol L-1 de íons Ca2+. A adição de íons fluoreto à água de distribuição é uma medida preventiva contra cáries. Sabendo que para CaF₂ o Kps é 4,0.10-11, a concentração máxima de íons fluoreto, que pode ser adicionada à água dura, sem que ocorra formação de precipitados em mol L-1 é, aproximadamente,
O produto de solubilidade dos compostos é de grande importância na química analítica, pois, com seu auxílio, é possível não só explicar como também prever as reações de precipitação. Ele também tem importantes aplicações no tratamento de esgoto sanitário, na extração de minerais da água do mar, na formação e perda de ossos e dentes e no ciclo global do carbono.
(ATKINS, P.W.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente, 5ª Edição, 2011.)
A respeito do produto de solubilidade, analise as afirmativas a seguir:
I. A constante do equilíbrio entre um sólido e seus íons dissolvidos é chamada de produto de solubilidade, Kps, do soluto.
II. A constante do produto de solubilidade, Kps para uma solução saturada de Ca(IO3)2 em água é Kps= [Ca+2][IO-3].
III. O produto de solubilidade Kps para o sal de prata AgX é 4,0 x 10-8. A solubilidade molar do AgX em água é 2,0 x 10-4 mol L-1.
IV. A comparação dos valores de Kps não pode ser usada para prever a ordem de precipitação de sais que apresentam a mesma proporção estequiometria entre cátion e ânion.
Está correto apenas o que se afirma em
Calcule a solubilidade molar do BaSO4 presente em uma solução de K2SO4 0,0108 mol/L. Dado Kps do BaSO4: 1,1.10-10.
Analise as alternativas a seguir.
I. Copo com álcool hidratado.
II. Copo com água e gelo.
III. Copo de água com gás.
O sistema heterogêneo com duas fases é observado apenas em:
Mercúrio (e seus compostos) é um tipo de contaminante que, em hipótese alguma, pode ser descartado na rede de esgoto, dado seu potencial tóxico e cumulativo. Contudo, sem ter como recuperar esse metal de um galão com 5 litros de resíduo de sais de mercúrio (I), o técnico do laboratório de Química Geral optou por reduzir o volume para encaminhar uma quantidade menor ao descarte. Para evitar riscos ou gasto de energia, ele optou pela técnica de precipitação. Consultando a tabela disponível nos manuais e na internet, ele encontrou as seguintes opções para a constante de produto de solubilidade (Kps) dos sais de mercúrio:
|
Fórmula do sal que será formado |
Kps |
Hg2Cl2 |
1,5x10-18 |
HgI2 |
2,8x10-19 |
Hg2(SCN)2 |
3,1x10-20 |
Hg2Br2 |
6,4x10-23 |
Hg(OH)2 |
3,1x10-26 |
Hg2I2 |
5,3x10-29 |
HgS |
1,6×10-54 |
Com base na tabela, qual contra-íon o técnico deve usar para que a precipitação do resíduo que ele possui seja máxima?
I. A temperatura crítica de pite é definida como a temperatura em que a corrente excede 100 microA/cm2 por 60s.
II. A temperatura crítica de pite é obtida através de técnica potenciodinâmica.
III. Em geral, o potencial crítico de pite diminui com o aumento da temperatura.
Dentre essas afirmativas, está(ão) correta(s)
A partir das informações do texto precedente, julgue o próximo item.
Sais muito solúveis são aqueles que apresentam valores
elevados da constante do produto de solubilidade (Kps) em
uma dada temperatura.
Nessa temperatura, o valor da constante do produto de solubilidade desse sal é, aproximadamente,
Considere-se que, para a reação FeS (s) ⇌ Fe2+ (aq) + S2− (aq), a 25 °C, a constante do produto da solubilidade (Kps) seja igual a 2,56 × 10−18. Nesse caso, quando o equilíbrio for alcançado, a solubilidade do FeS em água será inferior a 2 × 10−7 g/L, desconsiderando-se qualquer hidrólise posterior dos íons.
O cloreto de prata (AgCl) é um sal pouco solúvel em água pura, com um produto de solubilidade (Kps) igual a 1,8x10-10. Quando em contato com a água, apresenta uma baixa concentração de íons Ag+(1,34x10-5 mol/L) e íons Cl- (1,34x10-5 mol/L) no equilíbrio químico em solução devido à reação
AgCl(s) ⇄ Ag+ (aq) + Cl- (aq)
Em qual das soluções a seguir o sal AgCl será mais
insolúvel, quando comparado com a água pura?
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon 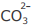
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon 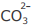
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon 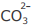
Está(ão) correta(s)