Questões de Concurso
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 91 questões
Na revelação de impressões digitais, uma das técnicas mais comuns envolve o uso de pós-reveladores como a ninidrina, o cianoacrilato e o nitrato de prata. Nesse último, o sal de prata reage com cloretos de secreções da pele, precipitando o cloreto de prata, sendo revelada com luz solar e fotografada rapidamente.
Sabendo que o produto de solubilidade desse sal é 1,8 x 10-10 mol/L, o composto a seguir que pode ser adicionado para recuperação da prata é o
Dados: Kps AgCl = 1,8x10-10; Kps PbCl2 = 1,7x10- 5 ; √8,5 = 2,9
I. O hidróxido de magnésio precipita primeiro que o hidróxido de cálcio. II. A concentração de íon magnésio que permanece na solução quando hidróxido de cálcio começa a precipitar é muito pequena. III. Não é necessário mais do que 0,06 mol/L de hidróxido de sódio para precipitar os dois íons na solução. Dados: Kps (Mg(OH)2 ) = 1,1 x 10–11; Kps (Ca(OH)2 ) = 5,5 x 10–6 Estão corretas as conclusões
Considere a mistura de 100 mL de sulfeto de sódio 0,2 mol L−1 com 100 mL de nitrato de chumbo 0,1 mol L−1 , resultando na formação do precipitado sulfeto de chumbo. A solubilidade, em mol L−1 , do sulfeto de chumbo na solução é de
(Dado: Kps PbS = 3,0x10−28)
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
A constante de equilíbrio K da reação do óxido de ferro (III) é corretamente expressa pela seguinte equação. K = [ Fe3+ ]y [ H20]z / [Fe2O3] [ H+]x
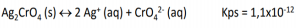
Supondo que não há mudança de volume com a adição do hidróxido de sódio e que a temperatura da solução, durante todo o processo reacional, permanece a 25 ºC, o químico chegou às seguintes conclusões:
I. O hidróxido de magnésio precipita primeiro que o hidróxido de cálcio. II. A concentração de íon magnésio que permanece na solução quando hidróxido de cálcio começa a precipitar é muito pequena. III. Não é necessário mais do que 0,06 mol/L de hidróxido de sódio para precipitar os dois íons na solução.
Dados: Kps (Mg(OH)2 ) = 1,1 x 10–11;
Kps (Ca(OH)2 ) = 5,5 x 10–6
Estão corretas as conclusões
Sabendo-se que o cloreto de prata, AgCl, e o brometo de prata, AgBr, são muito pouco solúveis em soluções aquosas, calcule o produto de solubilidade das substâncias pouco solúveis a partir das suas solubilidades molares:
1. AgCl = 1,265 × 10–5 mol.L–1
2. AgBr = 8,800 × 10–7 mol.L–1
Assinale a alternativa correta.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Cavernas de calcário são formadas pela ação de dissolução das rochas calcárias pela água subterrânea, que contém dióxido de carbono, conforme a equação química a seguir.
CaCO2 (s) + H2O + CO (aq) --> Ca(HCO2)2 (aq)
Considerando-se que Kps CaSO4 = 4,9 x 10 -5 e Kps PbSO4 = 2,5 x 10-8 a 25 oC, as concentrações em mol/L de sulfato, para que ocorra a precipitação do CaSO4 , do PbSO4 e o composto que precipitará primeiro são, respectivamente:
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
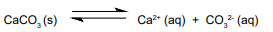
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
