Questões de Concurso
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 91 questões
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
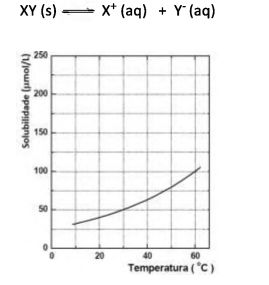
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?


Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
Considere que a reação entre antimônio e sulfeto produza
o sal Sb2S3, pouco solúvel e de cor ocre que, em meio
aquoso, dissocia-se parcialmente, de acordo com o
equilíbrio Sb2S3(s)2Sb3+(aq) + 3S2-
(aq). Nesse caso,
a concentração de sulfeto necessária para iniciar a formação
do sólido Sb2S3 em uma solução aquosa de Sb3+
de concentração x mol/L deverá ser maior que
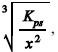 em que Kps é a constante de equilíbrio da reação precedente.
em que Kps é a constante de equilíbrio da reação precedente.
A adição de NH3(aq) a uma solução saturada de cloreto de prata em contato com o precipitado resultará
Solutos iônicos diferem enormemente em sua solubilidade na água. As regras de solubilidade são úteis para prever que precipitado será formado quando duas soluções são misturadas. Reações de precipitação podem ser representadas por equações iônicas líquidas. Os coeficientes na equação iônica líquida para uma reação de precipitação podem ser usados para relacionar o número de moles de reagentes e produtos. Titulações por precipitação são úteis para analisar um componente em uma mistura. Com relação à constante do produto da solubilidade Kps, calculamos:
I. A concentração de um íon na solução em equilíbrio com o sólido quando se conhece a concentração do outro íon.
II. Se haverá ou não formação de precipitado.
III. A solubilidade do sólido em água pura ou em uma solução contendo um íon comum.
Estão corretas as afirmativas
4 análises são realizadas ao mesmo tempo, nas mesmas condições e com a mesma concentração de Ag+ .
Dado:
Composto / Kps Agl / 8,3 x 10-17 AgBr / 5,2 x 10-13 AgCl / 1,8 x 10-10 AgIO3 / 3 x 10-8
Se as análises envolverem os íons I- , Br- , Cl- e IO3 - qual deles precipitará primeiro?
Considere uma solução aquosa 0,1 mol L−1 contendo os cátions Sr2+, Ca2+, Ba2+, Ra2+ e Pb2+.
Dadas as constantes do produto de solubilidade (KPS):
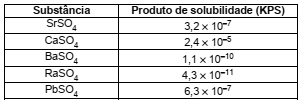
Se íons sulfato (SO2-4) forem gradualmente adicionados à solução acima,
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução que contenha íons Cd2+ na concentração
1,0 × 10-5
mol/L, uma concentração de íons S2- igual a
1,0 × 10-20 mol/L será suficiente para iniciar a precipitação do
CdS.
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução aquosa de H2S, a ordem
decrescente de concentração das espécies presentes
é [H2O] > [H3O+
] > [H2S] > [S2- ] > [HS- ].
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A concentração de íons S2- em uma solução aquosa de H2S
0,100 mol/L é inferior a 1,0 × 10-10.
Uma amostra contém Ba2+ e Ca2+ nas concentrações de 1 x 10-2 mol L-1 para cada íon. Esses íons devem ser precipitados na forma de sulfatos pouco solúveis, como apresentado nas equações abaixo.
BaSO4(s) ⇌ Ba2+(aq) + SO42-(aq) ; Kps1 = 1 x 10-10
CaSO4(s) ⇌ Ca2+(aq) + SO42-(aq) ; Kps2 = 1 x10-5
Quando a concentração de SO42- atingir um valor para permitir o início da precipitação do CaSO4, a concentração de Ba2+ na solução estará na ordem de grandeza, em mol L-1, de
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Sais de carbonatos são, na maioria, pouco solúveis. Num experimento, foram adicionadas soluções equimolares de cloretos de bário, cálcio, estrôncio, cádmio e cobalto num meio levemente alcalino.
Dados:
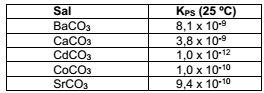
Ao passar do tempo, gás carbônico atmosférico se difunde no meio, causando precipitação de todos os cátions. Após
isso ocorrer, o cátion que estará em maior concentração será o de:
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
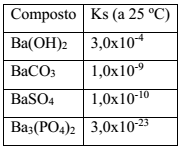
O procedimento que resulta na produção de um material mais adequado ao descarte é:
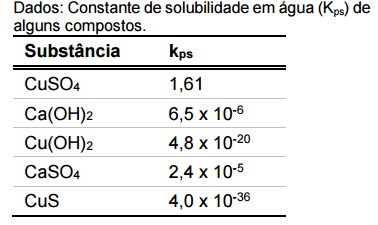
A calda bordalesa, muito utilizada como fungicida na agricultura, é preparada pela mistura de sulfato de cobre pentaidratado (CuSO4.5H2O), um pequeno excesso de cal (CaO) e água em proporção de 1:1:10 (m:m:v), respectivamente, obtendo-se uma suspensão muito fina (partículas pequenas).
De acordo com os dados de constante de solubilidade, assinale a alternativa que apresenta o constituinte principal do sólido suspenso na calda bordalesa.