Questões de Concurso
Sobre sistemas heterogêneos: produto de solubilidade (kps). em química
Foram encontradas 90 questões
Considerando-se que a constante do produto de solubilidade do cloreto de prata em água seja 1,0×10-10 mol/L, em uma solução saturada desse sal a concentração de íons prata será superior a 5,0 mg/L.
Dados de Kps :
BaCO3 = 5,0.10-9 ,
MnCO3 = 5,0.10-10 ,
Ag2 CO3 = 8,1.10-12 ,
ZnCO3 = 1,0.10-11
A concentração de cálcio numa solução saturada desse sulfato, em mol L-1 , é
Sais de carbonatos são, na maioria, pouco solúveis. Num experimento, foram adicionadas soluções equimolares de cloretos de bário, cálcio, estrôncio, cádmio e cobalto num meio levemente alcalino.
Dados:
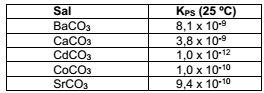
Ao passar do tempo, gás carbônico atmosférico se difunde no meio, causando precipitação de todos os cátions. Após
isso ocorrer, o cátion que estará em maior concentração será o de:
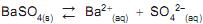
Sendo o seu produto de solubilidade a 25 o C igual a 1,0 x 10-10 , em solução saturada, a concentração de Ba 2+ , em mol/L, é
I – Ao se dissolver acetato de sódio em água, tem-se uma solução na qual [OH- ] < [H+]
II – O produto de solubilidade do cloreto de chumbo (II) é dado pela expressão: Kps = [Pb+] [Cl- ].
III – Os sais são substâncias de caráter iônico.
Está correto APENAS o que se afirma em
Sabendo-se que o produto iônico da água na mesma tem- peratura é Kw, a concentração de H+, é dada por:
Se um precipitado de cromato de prata está em equilíbrio com sua solução saturada, pode-se afirmar que há um equilíbrio heterogêneo
PORQUE
o Ag2CrO4 está na fase sólida, enquanto íons Ag⁺ e CrO42⁻ estão na fase dissolvida, sendo a expressão do produto de solubilidade igual à soma das concentrações molares dos íons. Assinale a alternativa CORRETA.
Sabendo que, para o Cd(OH)2 , a 25 °C, o Kps = 7,2x10–15, a concentração em mol/L de Cd2+que permanece em solução depois do tratamento com NaOH será igual a
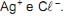 Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é
Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é 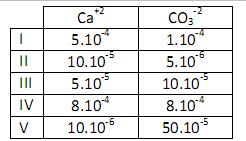
Dessa forma, podemos afirmar que
Dado: Kps (CaF2 ) = 3,9 x 10-11
Os pKs das carboxilas das cadeias laterais desses aminoácidos são respectivamente 5,9 e 4,5.
Sabe-se que o pH ótimo para a atividade da lisozima é 5,2. Nessa situação, é correto afirmar que os estados de ionização do Glu35 e Asp52 serão, respectivamente:
No meio aquoso, esses dois sais reagem instantaneamente, de acordo com a equação balanceada abaixo, e nela se forma um sal muito pouco solúvel.

A quantidade máxima, em gramas, de AgCL sólido (massa molar = 143,5 g/mol e Kps = 10-10 ) que se forma é de, aproximadamente,


