Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 197 questões
Dados: Kb(NH3)= 2x10–5
Nessa temperatura, o uso de 20 g de permanganato de potássio para preparar 250 mL de uma solução aquosa resultará em uma solução
Um determinado sal X possui solubilidade conforme o gráfico abaixo.
Uma solução saturada de 340g à 50°C foi resfriada até 10°C. Quanto em gramas de soluto precipitará?
Assinale a opção que completa corretamente as lacunas da setença abaixo:
A solubilidade de sólidos e líquidos em solventes líquidos é praticamente independente do(da) _______ . Já os gases se dissolvem em líquidos com uma diminuição considerável do(da) _______ . Isto significa que no equilíbrio
soluto(g) + solvente (I) ⇌ solução (I)
o aumento do(da) _______ favorece a formação da solução. De acordo com o enunciado da Lei de_________, a solubilidade de um gás dissolvido em um líquido é proporcional à pressão parcial do gás acima do líquido.
Duas formas de corrosão conhecidas são a corrosão galvânica e a corrosão eletrolítica. Sobre suas propriedades, marque a opção correta.
A solubilidade das substâncias varia em função da temperatura, sendo a magnitude dessa variação característica do tipo de soluto. A curva mostrada na figura abaixo é característica para o sal cloreto de amônio. Qual a massa de sal que pode ser dissolvida para preparar 300 mL de uma solução saturada a 70°C?
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
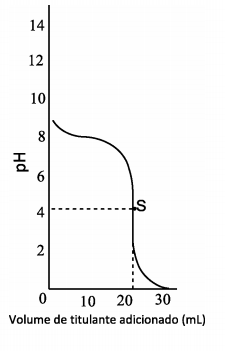
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
Em um laboratório de oceanografia química, um técnico analisou uma amostra de água de um canal e percebeu elevada turbidez. Acerca dessa característica, considere as afirmativas a seguir.
1) Deve-se à presença de íons em solução, como sódio e nitrato (Na+ e NO3").
2) É causada pela presença de partículas em suspensão que podem ter origem orgânica ou inorgânica.
3) Pode ser medida em laboratório utilizando-se um turbidímetro.
Está(ão) correta(s), apenas:
Assinale a alternativa correta.
A tabela a seguir contém os valores das constantes de equilíbrio de alguns ácidos e bases.
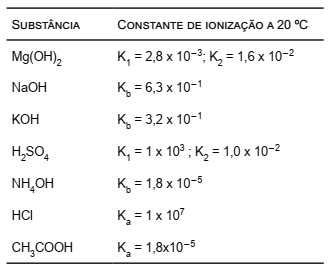
Uma das reações de identificação dos íons magnésio consiste em precipitá-lo com base forte, formando o hidróxido de magnésio, branco, segundo a equação:
Mg2+ (aq) + 2OH–(aq)  Mg(OH)2
(s)
Mg(OH)2
(s)
O precipitado formado pode ser dissolvido quando ao
meio aquoso é adicionado o sal