Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 190 questões
Um estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Observe a tabela de solubilidade abaixo.
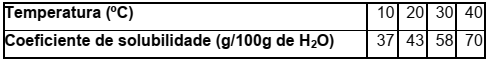
Em uma solução, preparada em um laboratório, foram dissolvidas 27 gramas de soluto em 100
gramas de água, à temperatura de 20 °C. Essa solução será
Um laboratorista construiu o seguinte gráfico durante uma titulação ácido-base.
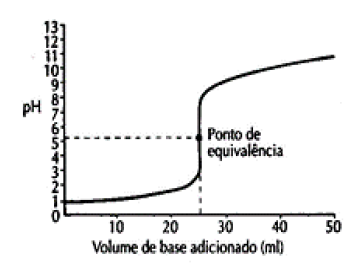
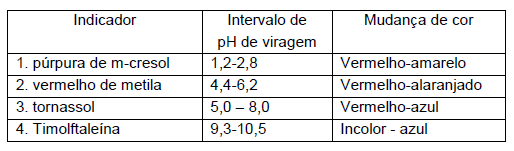
Dos 4 indicadores, qual seria o mais adequado para determinar o ponto de equivalência?
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
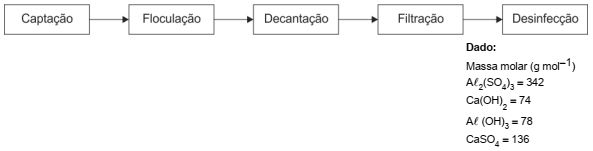
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
Atenção: Para responder à questão, considere a curva de titulação abaixo.

Atenção: Para responder à questão, considere a curva de titulação abaixo.

Observe a curva de titulação do ácido fosfórico H3PO4 . As setas indicam a faixa de pH onde predominam seus íons correspondentes.
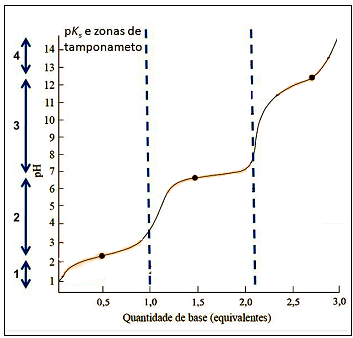
Em qual faixa de pH predomina o íon HPO42-?
Na titulação fotométrica, com monitoramento da absorvância da solução em 330 nm, o analito A, em solução, reage com o reagente titulante T para formar o produto P de acordo com a equação a seguir:
A(aq) + T(aq) → P(aq)
A curva de titulação obtida é mostrada abaixo.
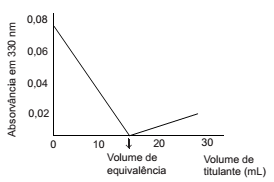
Com base nas informações acima, conclui-se que
Um resíduo aquoso, de volume igual a 30,0 L, contém dissolvidos 1,0 × 10-2 mol L-1 de Pb2+ e 2,0 × 10-2 mol L-1 de Hg22+. Esses íons foram precipitados com a adição de uma solução aquosa de ácido sulfúrico 1,0 mol L-1 , de acordo com as equações a seguir, em volume suficiente para garantir excesso de sulfato.
Pb2+ (aq) + SO4 2- (aq) → PbSO4 (s)
Hg2 2+ (aq) + SO4 2- (aq) → Hg2 SO4 (s)
A massa de precipitado, em gramas, que seria obtida, considerando a reação quantitativa, é mais próxima de
Dados
M (PbSO4 ) = 303 g mol-1
M (Hg2 SO4 ) = 497 g mol-1
O gráfico a seguir apresenta a solubilidade de uma substância em diversas temperaturas.
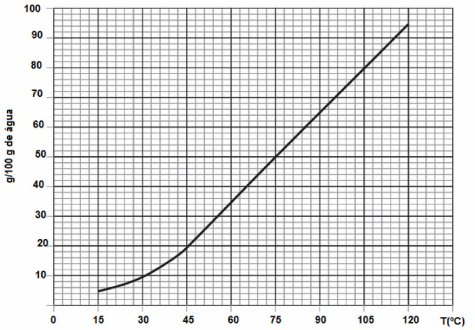
Em um bequer, 150 gramas dessa substância foram solubilizadas em 250 gramas de água, até a temperatura de 105°C. Em seguida, a solução foi resfriada em 30°C. A massa da substância,
em g, que se deposita no fundo do béquer é igual a
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH- ] e pKb = -log Kb, julgue o seguinte item.
Uma solução-tampão constituída por NH4Cℓ 0,040 mol/L e NH3 (aq) 0,030 mol/L apresenta pOH superior ao pKb da NH3.
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH- ] e pKb = -log Kb, julgue o seguinte item.
A solubilidade de um sulfeto metálico é tanto menor quanto
maior for a acidez do meio.
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita,
tiverem sido gastos 16,0 mL da solução que contenha o
excesso de NaOH, então infere-se que a concentração da
solução de H2S é igual a 9,00 × 10-2
mol/L.
Uma amostra contém Ba2+ e Ca2+ nas concentrações de 1 x 10-2 mol L-1 para cada íon. Esses íons devem ser precipitados na forma de sulfatos pouco solúveis, como apresentado nas equações abaixo.
BaSO4(s) ⇌ Ba2+(aq) + SO42-(aq) ; Kps1 = 1 x 10-10
CaSO4(s) ⇌ Ca2+(aq) + SO42-(aq) ; Kps2 = 1 x10-5
Quando a concentração de SO42- atingir um valor para permitir o início da precipitação do CaSO4, a concentração de Ba2+ na solução estará na ordem de grandeza, em mol L-1, de
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

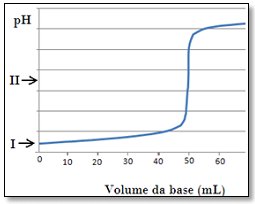
A figura apresentada ao lado representa a titulação para 100 mL de uma solução de HCl com uma solução padrão de NaOH 0,2 mol L-1 .
Os valores de pH indicados pelas setas no gráfico são, respectivamente:
A determinação da concentração de íons cloreto em águas é um importante parâmetro para se medir sua qualidade. Íons cloreto reagem com íons prata, gerando o cloreto de prata insolúvel.
Dados: M (g.mol-1 ): Ag = 108; Cl = 35,5; N = 14; O = 16.
A partir da estequiometria da reação de precipitação do cloreto de prata, a massa de nitrato de prata necessária para reagir com 250 mL de uma amostra contendo 250 mg.L-1 de íons cloreto é:
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
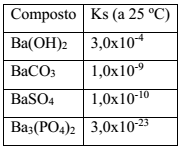
O procedimento que resulta na produção de um material mais adequado ao descarte é: