Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 197 questões

Uma mistura foi preparada acrescentando-se 100,00 g de bicarbonato de sódio a 1 kg de água a 20 ºC. Em seguida, foi aquecida até a temperatura de 50 ºC. Com base nessas informações, conclui-se que a massa, em gramas, de corpo de fundo presente na mistura, antes e depois do aquecimento, foi, respectivamente,

KHC8 H4 O4(aq) + NaOH(aq) → KNaC8 H4 O4(aq) + H2 O(l)
A solução aquosa de NaOH a ser padronizada e a água usada na preparação do padrão primário foram tratadas para ficar isentas de CO2 dissolvido. Em pesa-filtro de forma baixa pesaram-se 7,4245 g de biftalato de potássio. A essa massa foi adicionada água suficiente para a sua dissolução total de forma que o padrão primário fosse transferido quantitativamente para balão volumétrico de 250,00 mL, onde o volume foi ajustado até o traço de referência pela adição de água. Uma alíquota de 25,00 mL dessa solução foi titulada com a solução de NaOH, usando a fenolftaleína como indicador do ponto final.
Sendo o volume da solução aquosa de NaOH gasto na titulação, até a mudança de cor da fenolftaleína para rosa claro, igual a 22,78 mL, a concentração em quantidade de matéria (mol/L) da solução de NaOH é
Dado M(KHC8H4O4) = 204,23 g/mol
Esse processo é conhecido como
SACAROSE C12H22O11 Constante crioscópica e ebuloscópica para água: 1,86 kg/mol e 0,51 kg/mol Densidade da água e do etanol: 1,0 g/cm³ e 0,78 g/cm³ |
FOSFATO DISSÓDICO Na2HPO4 MM = 142,0 g/mol constante do produto de solubilidade: 0,63 a 25º C FOSFATO MONOSSÓDICO NaH2PO4 ⇔ Na+ + H+ + HP4 MM = 120,0 g/mol pKa = 6,8 |
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
A solubilidade do fosfato dissódico a 25ºC é maior que 100 g L-1.
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativos à análise gravimétrica e aos fatores que a influenciam.
A técnica gravimétrica de precipitação em solução homogênea
consiste na precipitação do analito por um agente precipitante
que é gerado por uma reação química lenta na própria solução.
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativos à análise gravimétrica e aos fatores que a influenciam.
Nucleação e peptização são processos que favorecem a
obtenção de precipitados com maior tamanho de partícula, o
que facilita a filtração em gravimetria.
Quantos gramas de Ca3(P04)2 são formados?
assertivas.

II. Não haverá o desprendimento de Cl2(g) ou O2(g).
III. A mistura das soluções será apenas um fenômeno físico.
IV. Haverá a formação de um precipitado.
V. Não ocorrerá reação, pois não será possível a formação de um precipitado.
É correto o que se afirma em :
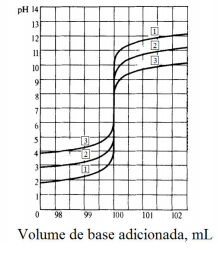
clássico, amplamente empregado para a determinação da
acidez ou da alcalinidade. A figura abaixo mostra as
curvas de titulação de um ácido forte, com três
concentrações diferentes, e uma base forte.
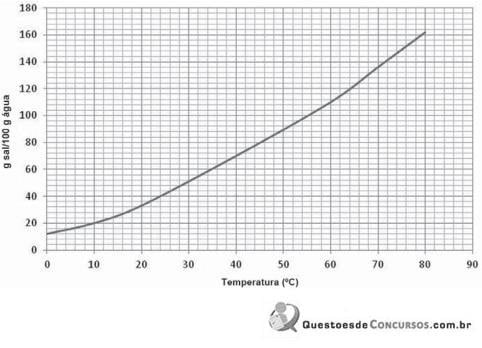
Uma solução saturada desse sal pesando 170 g e na temperatura de 40 °C foi resfriada a 10 °C. A massa do sal, em g, que precipita formando um sólido no fundo do frasco (corpo de fundo) é aproximadamente igual a
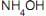 até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de
até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de 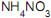 , (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.
, (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.A etapa que apresenta sua definição de acordo com os princípios da análise gravimétrica é: