Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 197 questões
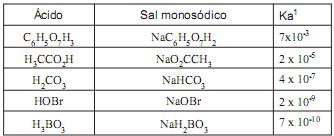
Com base nos valores da constante de equilíbrio da primeira dissociação ácida em meio aquoso (Ka1 ) dos ácidos listados, um dos pares ácido/ sal monosódico foi escolhido para a preparação da solução tampão. Desta forma, massa correspondente a 0,16 mol do sal monosódico foi pesada e transferida quantitativamente para um balão volumétrico de 1 litro. Para se obter 1 litro da solução tampão desejada, a massa do ácido pesada e transferida quantitativamente para o balão volumétrico contendo o sal monosódico deve ser
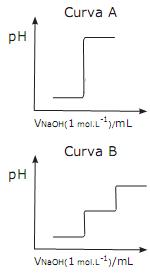
Curva A e Curva B correspondem respectivamente à titulação ácido/base de soluções dos ácidos
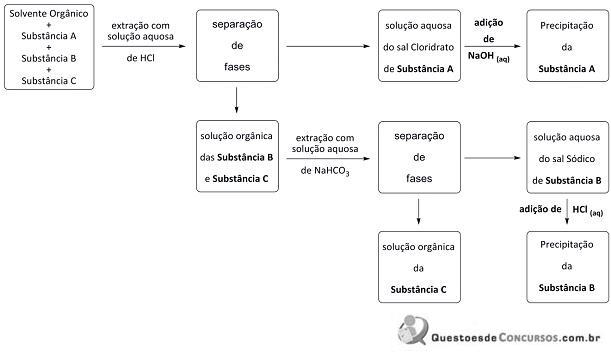
Sabendo que os valores de Ka do ácido clorídrico (HCl) e Ka do bicarbonato de sódio (NaHCO3 ) medidos em água são respectivamente 1,0 x 107 e 4,7 x 10-11 , podemos afirmar que a ordem crescente de valores de Ka das Substância A, Substância B e Substância C deve ser:
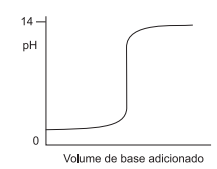
Considere a curva de titulação produzida quando uma base forte é adicionada a um ácido forte.
O pH da solução, quando 50 mL da base forte de concentração de 0,1 mol/L são adicionados a 51 mL do ácido forte de concentração de 0,1 mol/L, é de
Em um mundo cada vez mais propenso à ecologia e sustentabilidade, os tecidos não tecidos (TNT) biodegradáveis aparecem com mais evidência. Descartáveis higiênicos de polipropileno e fraldas podem ser substituídos por poliésteres alifáticos biodegradáveis. Nesse contexto, julgue os itens subsequentes.
O ácido PLA é degradado pela natureza, com a ação de enzimas, por hidrólise.
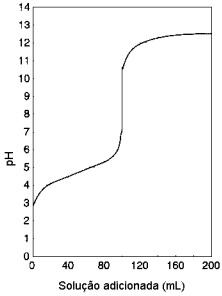
Considerando as soluções 0,1 mol/L de ácido acético, de ácido clorídrico, de hidróxido de sódio e de amônia, pode-se afirmar que a curva refere-se à adição da solução de
A concentração de Al3+,em mol/L, na solução, é igual a
A 25,00 mL dessa solução adicionou-se, lentamente e com agitação constante, uma solução aquosa de hidróxido de amônio até a precipitação completa de hidróxido de Fe III (Reação I).
Fe3+ (aq)+ 3 OH - (aq) → Fe(OH) 3(s) Reação I
Após envelhecimento do precipitado em sua água-mãe, procedeu-se à filtração e à lavagem do precipitado. O precipitado foi transferido para um cadinho previamente tarado, onde foi feita a sua calcinação (Reação II).
2Fe(OH) 3(s) → Fe2 O 3(s) + 3H2 O(g) Reação II
Sendo a massa de Fe2 O3(s)obtida após a calcinação, igual a 0,40 g, qual a concentração de Fe 3+ na solução original, em g/L?
Dados:
massa molar do Fe = 56 g/mol
massa molar do Fe2 O3 = 160 g/mol
Qual o coeficiente de solubilidade (CS) dessa solução?
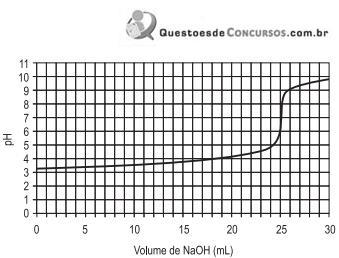
 0,0005M foi analiticamente padronizada, titulando-se um volume de 50 mL dessa solução com uma solução 0,001M de NaOH, sendo acompanhado o parâmetro pH durante a adição da solução de NaOH.
0,0005M foi analiticamente padronizada, titulando-se um volume de 50 mL dessa solução com uma solução 0,001M de NaOH, sendo acompanhado o parâmetro pH durante a adição da solução de NaOH. A curva titulométrica resultante é apresentada no gráfico.
VOGEL, A. I. Análise Química Quantitativa. Rio de Janeiro: LTC, 2002. Adaptado.
Indicador Faixa de pH de mudança de cor
Vermelho de metila 4,2 – 6,3
Verde de bromocresol 3,8 – 5,4
Azul de bromotimol 6,2 – 7,6
Alaranjado de metila 3,1 – 4,4
Fenolftaleína 8,3 – 10,0
Considerando-se os indicadores ácido-base listados após o gráfico, qual o indicador apropriado para a realização dessa análise?
 em peso), completando-se com água até um volume final de 2,0 L.
em peso), completando-se com água até um volume final de 2,0 L. Qual o teor residual de prata na solução?
Dado: Ks AgC
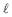 = 1,8 x 10-10
= 1,8 x 10-10 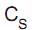 = 180 g/100 g
= 180 g/100 g 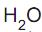 . Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?
. Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?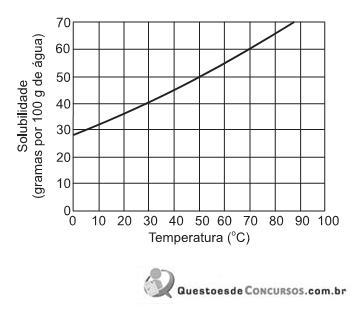
A massa de cloreto de amônio presente em 250 g de uma solução saturada a 50 °C é, em gramas, aproximadamente,
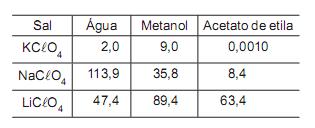
O sal diet é uma mistura de cloreto de potássio e cloreto de sódio, contendo quantidade traço de cloreto de lítio. Uma amostra de 4,5 g seca de sal diet foi pesada e analisada para determinar-se a percentagem em massa de cloreto de potássio. Para tal, a mistura de cloretos alcalinos foi tratada com ácido perclórico de modo a converter os sais cloretos em sais percloratos. A amostra foi seca e, em seguida, foi adicionada em 100 mL de acetato de etila, nos quais o potássio se precipitou na forma de KClO4 (ver dados de solubilidade na tabela acima). O sobrenadante foi separado, e o precipitado lavado com acetato de etila, antes de ser seco e pesado na balança analítica. Qual a percentagem, em massa, de KCl na amostra se a massa de KClO4 obtida foi igual a 2,77 g?
- o produto precipitado deve ser suficientemente insolúvel para que não ocorram perdas na filtração e lavagem;
- a natureza física do precipitado deve ser tal que permita ser separado da solução por filtração e possa ser lavado até ficar livre de impurezas solúveis;
- o produto precipitado deve ser conversível em uma substância pura de composição química;
- o agente precipitante não deve ser reativo com os constituintes da atmosfera.
Considerando que o produto de solubilidade do AgCl, em água pura, seja 1,6 x 10-10 (Kps a 25 °C) e que a solubilidade do AgCl seja 1,3 x 10-5 mol/L, qual seria a solubilidade de Ag+ em uma solução de NaCl 0,10 M?
Até que temperatura deve ser resfriada, no cristalizador, a solução saturada?