Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 190 questões
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2G
foi
reduzido a Cr3+.
Com base nas situações apresentadas acima, julgue o item a seguir, relativos à química analítica clássica.
Diferentemente da volumetria de neutralização, a volumetria
de oxirredução é limitada pela impossibilidade de se utilizar
indicadores que acusem o final da titulação por meio da
mudança de cor do sistema.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Na situação II, a concentração de Fe2+ na amostra é superior a 0,010 mol/L.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
O ácido titulado na situação I é mais forte que o ácido propiônico, que tem pKa = 4,9.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Na situação I, a concentração do ácido titulado é o dobro da concentração da base utilizada nessa titulação.
A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
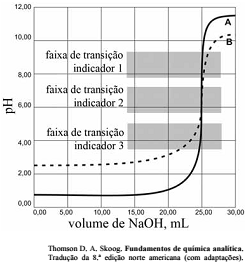
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A titulação representada pela curva A mostra uma solução mais ácida do que a mostrada pela curva B.
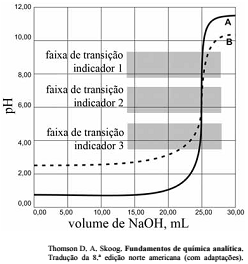
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A figura mostra a titulação de um ácido fraco com uma base forte.
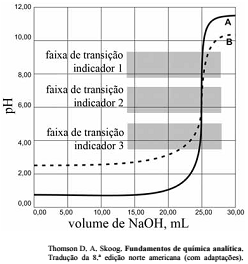
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativos à análise gravimétrica e aos fatores que a influenciam.
A técnica gravimétrica de precipitação em solução homogênea
consiste na precipitação do analito por um agente precipitante
que é gerado por uma reação química lenta na própria solução.
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativos à análise gravimétrica e aos fatores que a influenciam.
Nucleação e peptização são processos que favorecem a
obtenção de precipitados com maior tamanho de partícula, o
que facilita a filtração em gravimetria.
Em um laboratório de química analítica, um estudante encontrou um frasco com uma solução contendo, o seguinte rótulo: “cátion do grupo IV”. Para rotular corretamente, o aluno realizou alguns testes com alguns reagentes comuns para identificação de cátions do grupo IV e fez as seguintes observações:
1º) Ao fazer o teste utilizando solução de amônia, nenhum precipitado foi observado;
2º) Empregando uma solução de carbonato de amônio, um precipitado de cor branca foi formado, sendo este solúvel em ácidos minerais diluídos;
3º) Após utilizar ácido sulfúrico diluído, ocorreu a precipitação de um sólido branco, pesado e finamente dividido, que foi praticamente insolúvel em água.
Com base nos testes e observações do
estudante, o cátion presente no frasco mal
rotulado é?
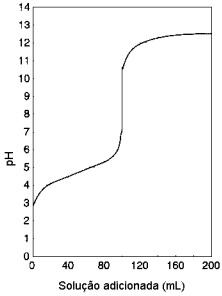
Considerando as soluções 0,1 mol/L de ácido acético, de ácido clorídrico, de hidróxido de sódio e de amônia, pode-se afirmar que a curva refere-se à adição da solução de