Questões de Concurso
Sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 197 questões
2g de uma mistura de sulfato de sódio e cloreto de potássio são tratados pelo nitrato de bário, obtendo-se um precipitado branco, que em seguida é lavado e seco e pesou 1,165g. A composição centesimal da mistura é:
Dados: Ba=137,33; Na=23,0; S=32,0; N=14,0; Cl=35,5 e K=39,0
Em relação à solubilidade em água das substâncias, são feitas as seguintes afirmativas:
I Os principais ácidos minerais são solúveis.
II Todos os nitratos são insolúveis em água.
III Os iodetos são insolúveis em água, exceto os de prata, chumbo e mercúrio.
IV Os permanganatos são todos solúveis em água.
V Os nitritos são solúveis em água, exceto o de prata.
Das afirmativas acima, estão corretas apenas:
Cristais macroscópicos idiomórficos podem ser produzidos pela evaporação de água à temperatura ambiente de soluções aquosas supersaturadas. As solubilidades, a 20ºC, de alguns sais e sua respectiva toxicidade podem ser vistas na tabela abaixo:
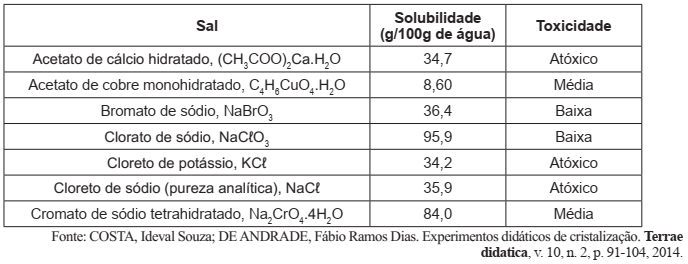
De acordo com os dados acima é correto afirmar que:
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
O carbonato de cálcio, presente no calcário, reage com o íon hidrônio, formando íons bicarbonato em água, conforme mostrado na equação seguinte.
CaCO3 (s) + H3O+ (aq) <=> HCO3 -(aq) + Ca2+ (aq) + H2O (l)
A seguir, uma curva típica de pH em função do volume adicionado para uma titulação.
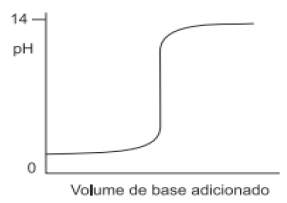
Observando essa curva, assinale a alternativa que apresenta, respectivamente:
I. O pH de viragem para uma titulação ácido forte-base forte completa (o ponto de equivalência); II. O titulante utilizado (ácido/básico).
Um estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Um laboratorista construiu o seguinte gráfico durante uma titulação ácido-base.
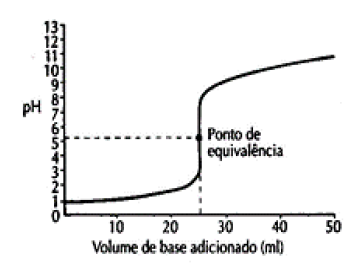
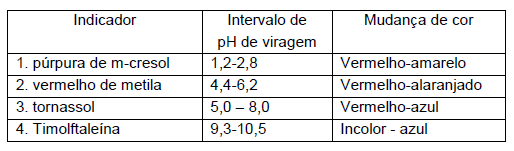
Dos 4 indicadores, qual seria o mais adequado para determinar o ponto de equivalência?
Considere a curva de titulação:
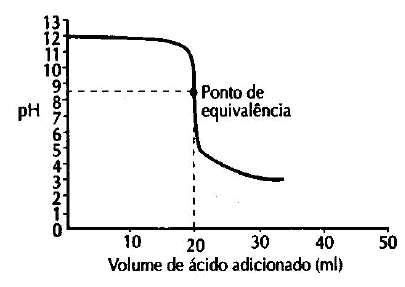
Analisando o gráfico, podemos considerar que o titulante e o titulado são, respectivamente:
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
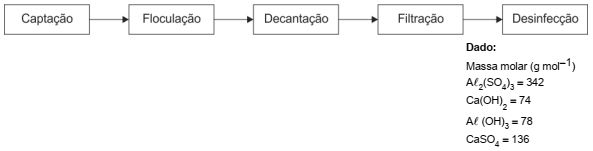
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
Atenção: Para responder à questão, considere a curva de titulação abaixo.

Atenção: Para responder à questão, considere a curva de titulação abaixo.

Observe a curva de titulação do ácido fosfórico H3PO4 . As setas indicam a faixa de pH onde predominam seus íons correspondentes.
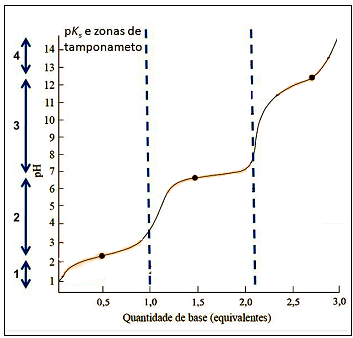
Em qual faixa de pH predomina o íon HPO42-?
Na titulação fotométrica, com monitoramento da absorvância da solução em 330 nm, o analito A, em solução, reage com o reagente titulante T para formar o produto P de acordo com a equação a seguir:
A(aq) + T(aq) → P(aq)
A curva de titulação obtida é mostrada abaixo.
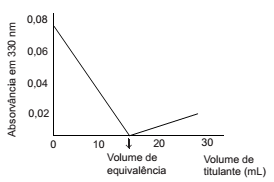
Com base nas informações acima, conclui-se que
