Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.244 questões
O ácido perclórico P.A. apresenta concentração de 70%, sabendo que a densidade do ácido perclórico é 1,68g/cm-3 , assinale a alternativa que apresente o volume aproximado de solução do ácido que deve ser adicionado a um balão volumétrico de 200mL, afim de preparar uma solução 0,1 mol/L.
Dados M=100,46g.mol-1
Qual é a concentração de íons sódio, em mol/L, presentes em 10g de cloreto de sódio dissolvidos em 50mL de água?
(Considere: MMNa=23g/mol, MMCI=35g/mol)
Dado: MMetilenoglicol= 62g;mol
Foi detectada a presença de 32µg de dióxido de enxofre em 100L de ar de um recinto fechado que se encontra a 25°C (a 1 atm).
A composição em ppm (v/v) desse poluente no recinto, considerando o comportamento ideal dos gases, é aproximadamente igual a
Dados: Constante dos gases = 0,082 atm.L.mol–1 .K–1 . Massa molares (g.mol–1 ): S = 32 e O = 16
O nitrogênio amoniacal é um parâmetro relevante para avaliação da qualidade da água e pode ser determinado pelo método de Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de um efluente foi adequadamente transformado em amônia que foi recolhida em solução de ácido bórico. Posteriormente o borato formado foi titulado, consumindo 24 mL de solução padrão de ácido sulfúrico 0,5 mol.L-1 .
A massa de nitrogênio (em mg) presente na amostra, é aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N = 14.
O conceito de solubilidade pode ser trabalhado em sala de aula por meio de análise da curva de solubilidade apresentada sob a forma de gráficos e/ou da realização de experimentos simples que mostrem os fatores que alteram a solubilidade.
Após uma discussão sobre esse assunto em sala de aula foram levantados pelos alunos alguns fatores que alteram a solubilidade tais como: o solvente, o ponto de fusão do soluto, a temperatura da solução, a pressão, as interações intermoleculares envolvidas.
O fator apresentado pelos alunos que deve ser rediscutido por não influenciar na solubilidade das substâncias é
sal ΔHsol (kJ/mol) solubilidade em água a 18 ºC (g/100 mL)
LiF +32 0,3
KF +2 92,3
RbF 3 130,6
Considerando os dados na tabela precedente, que lista alguns sais
e seus respectivos valores de entalpia de dissolução (ΔHsol) e
solubilidade, assinale a opção correta a respeito de soluções e
propriedades de soluções.
Para preparar 500 mL de uma solução de ácido clorídrico, HCl, 6,0 mol/L, um funcionário de um laboratório químico empregou uma solução de ácido clorídrico de concentração 12 mol/L.
O volume do ácido clorídrico 12 mol/L empregado para a preparação da solução 6,0 mol/L foi
Um funcionário de laboratório de análises precisa preparar 1 L de uma solução de hidróxido de sódio, NaOH, massa molar 40 g/mol, com concentração 0,5 mol/L.
Assinale a alternativa que apresenta a massa de hidróxido de sódio que deve ser empregada para o reparo dessa solução.
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
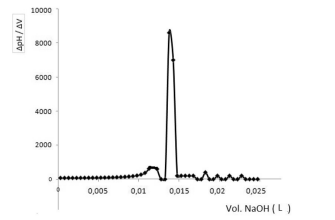
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
O ponto estequiométrico, de equivalência ou final teórico de uma titulação é aquele calculado com base na estequiometria da reação envolvida na titulação.
Na técnica de volumetria, a solução padrão é a solução cuja concentração é conhecida com exatidão e que estará sendo usada para comparação das concentrações.
Para realizar a técnica de volumetria, não deve haver um indicador que provoque mudanças de propriedades físicas como a cor.
