Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.294 questões
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
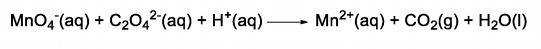
A semirreação de redução está corretamente representada em:
Um dos ligantes mais amplamente utilizados nas titulações de complexação é o EDTA, cuja fórmula estrutural é mostrada abaixo:
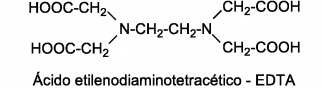
Sobre esse importante reagente, é incorreto afirmar:
Para determinar a pureza de uma amostra de 500,0 mg de Na2B4O7(s), um técnico realizou uma titulação com solução de HCl 0,020 M. A reação é:
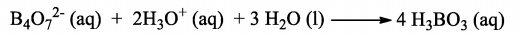
Sabendo que o volume utilizado da solução ácida foi 200,0 mL, é correto afirmar que a pureza da amostra em termos percentuais é:
Massas molares (g/mol): H = 1; B = 11; O = 16; Na = 23; Cl = 35,5.
Na padronização de uma solução de Ba(OH)2, utilizou-se 0,61 g do padrão primário ácido benzoico (C6H5COOH). O ponto final foi observado após a adição de 250,0 mL da solução básica. É correto afirmar que a concentração molar de Ba(OH)2 na solução é:
Massas molares (g/mol): H = 1, C = 12, O = 16 e Ba = 137.
Uma massa de 0,0575 g de um sal foi medida em balança, foi dissolvida em água e transferida para um balão volumétrico, onde o volume final foi ajustado para 25,00 mL.
Considerando as devidas precisões dos aparatos e respeitando os algarismos significativos, a concentração, em g L -1 , da solução é
Deseja-se preparar 800 mL de solução aquosa de hidróxido de sódio com pH igual a 12 e a 25 °C.
Assumindo-se completa dissociação do hidróxido de sódio em solução, a massa de base necessária para o preparo da solução, em g, corresponde a
Em uma prática de laboratório, 1 L de solução aquosa foi obtido ao se misturar 600 mL de solução 0,010 mol/L de cloreto férrico e 400 mL de solução 0,020 mol/L de cloreto de cálcio.
Admitindo-se completa dissociação dos sais, a concentração de íons cloreto na mistura formada, em mol/L, é igual a
Massas atômicas: H = 1; N = 14; O = 16.
Dados: Massa atômica do Na = 23 u Massa atômica do Cl = 35,5 u
É correto afirmar que a concentração molar da solução de HCl, expressa em mol/L, deverá ser:
Considerando-se que a densidade da solução é 1 g/mL, o teor de Ca2+ na solução em ppm (partes por um milhão de partes) é