Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.244 questões
Observe o gráfico com curvas hipotéticas de solubilidade de sais em água em diferentes temperaturas.
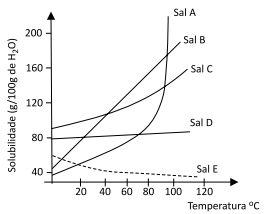
Conforme o gráfico, o fenômeno exotérmico de dissolução é observado no Sal