Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.294 questões
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Considere‐se que uma alíquota de 5 mL de uma solução aquosa de cloreto de potássio com concentração igual a 1 mol L−1 seja transportada para um balão volumétrico de 1.000 mL. Nesse caso, após ser realizada a diluição dessa alíquota até o preenchimento do balão volumétrico, a nova concentração dessa solução será igual a 0,02 mol L−1.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Titulação é a análise da composição pela medida do volume de uma solução (titulante) necessário para reagir com um determinado volume de outra solução. Em uma titulação ácido‐base, um ácido é titulado com uma base.
A titulação é realizada com a adição gradativa de uma
solução de um reagente à solução de outro, até que o ponto de equivalência seja assinalado por uma mudança de cor ou outra indicação.
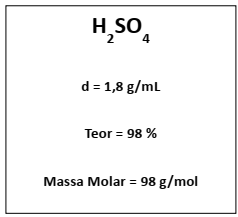
Deseja-se preparar 1 L de solução do ácido a 1 mol/L, partindo do reagente concentrado. Podemos informar que o volume do ácido concentrado a ser usado na preparação vale, aproximadamente:
A massa de hidróxido de sódio necessária à preparação de 500 mL de uma solução 0,2 mol/L, é:
Adotar nessa questão, massas atômicas: H = 1, O = 16, Na = 23.
Email institucional
Para: laborató[email protected]
Prezado técnico de laboratório
Solicito 100 mL de solução de ácido clorídrico de concentração 0,5 mol/L para realização de aula experimental, às 14 (catorze) horas do dia 23/04/2018.
Cordialmente,
Dr. Ernesto Rutherford
O técnico de laboratório precisará preparar a solução solicitada a partir do reagente ácido clorídrico PA 37% (massa/massa). Quanto de reagente, em mililitros, será necessário para o preparo da solução?
Dados: densidade ácido clorídrico= 1,20 g/mL;
Massas molares (g/mol): H= 1; Cl= 35,5
Considerando-se que as massas molares em g.mol-1 são S=32, H= 1 e O= 16, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente,
Obs.: Massas molares em g.mol-1 : Na = 23 e Cl = 35,5.
A acidez do leite na amostra, expressa em porcentagem (massa/volume) é, aproximadamente:
A concentração aproximada de pireno nessa solução, expressa em mol.L-1 , é
Alguns reagentes específicos podem ser empregados na identificação de drogas ilícitas, por meio da formação de produtos coloridos e rapidamente identificáveis a olho nu, como o reagente de Marquis, empregado para identificar metanfetaminas; o reagente de Scott, usado para identificar cocaína; e o reagente de Simons, usado para discriminar entre anfetaminas e metanfetaminas.
O volume de formaldeído 45% (densidade = 0,815 g × cm-3 ; massa molar = 30,031 g mol-1 ) necessário para se preparar 100 mL de uma solução de concentração 1,0 mol L-1 é superior a 82 mL.
5 Fe2+(aq) + MnO4-(aq) + 8 H+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 8 H2O(aq)
O ponto estequiométrico é atingido quando todo o Fe2+ reagiu, e a detecção é feita quando a cor característica da solução contendo íons MnO4- persiste. Para dissolver uma amostra de 202 mg de minério em ácido clorídrico, foram necessários 16,7 mL de uma solução 1,08 x 10-2 mol L-1 de KMnO4 para atingir o ponto estequiométrico. Qual é a porcentagem em massa de ferro na amostra?
Massa específica HCl = 1,19 g/mL; massa molecular em gramas 36,5 g/mol
Considere: densidade da água é igual a 1,044 g/cm³ e as massas molares: H = 1,0 g/mol; Cl = 35,5 g/mol.