Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.245 questões
A acidez do leite na amostra, expressa em porcentagem (massa/volume) é, aproximadamente:
A concentração aproximada de pireno nessa solução, expressa em mol.L-1 , é
Alguns reagentes específicos podem ser empregados na identificação de drogas ilícitas, por meio da formação de produtos coloridos e rapidamente identificáveis a olho nu, como o reagente de Marquis, empregado para identificar metanfetaminas; o reagente de Scott, usado para identificar cocaína; e o reagente de Simons, usado para discriminar entre anfetaminas e metanfetaminas.
O volume de formaldeído 45% (densidade = 0,815 g × cm-3 ; massa molar = 30,031 g mol-1 ) necessário para se preparar 100 mL de uma solução de concentração 1,0 mol L-1 é superior a 82 mL.
Massa específica HCl = 1,19 g/mL; massa molecular em gramas 36,5 g/mol
“Normal”: 60 g de sacarose em frascos de 500 mL. “Light” (teor reduzido de açúcar): 100 g de sacarose em frascos de 1 L. Dado: densidade do refrigerante a 20 °C = 1,04 g/mL
Assinale a alternativa em que a afirmativa está INCORRETA:
Texto para a questão.
Surfactantes ou agentes tensoativos são moléculas que se associam espontaneamente, em solução aquosa, a partir de uma determinada concentração. Apresentam uma região apolar e outra polar, ou iônica, e podem ser divididos em neutros ou iônicos. Os tensoativos iônicos podem ser catiônicos ou aniônicos ou, ainda, anfóteros, quando ambas as cargas estão presentes no surfactante. Em soluções diluídas, as moléculas dos surfactantes apresentam-se dispersas e, em soluções mais concentradas, organizam-se em agregados moleculares, que geralmente contêm de 50 a 100 moléculas, denominadas de micelas.
I. M. Rizzatti, D. R. Zanette e L. C. Mello. Determinação
potenciométrica da concentração micelar crítica de
surfactantes: uma nova aplicação metodológica
no ensino de química. In: Química Nova, v. 32,
n.° 2, 2009, p. 518-521 (com adaptações).
Texto para a questão.
Surfactantes ou agentes tensoativos são moléculas que se associam espontaneamente, em solução aquosa, a partir de uma determinada concentração. Apresentam uma região apolar e outra polar, ou iônica, e podem ser divididos em neutros ou iônicos. Os tensoativos iônicos podem ser catiônicos ou aniônicos ou, ainda, anfóteros, quando ambas as cargas estão presentes no surfactante. Em soluções diluídas, as moléculas dos surfactantes apresentam-se dispersas e, em soluções mais concentradas, organizam-se em agregados moleculares, que geralmente contêm de 50 a 100 moléculas, denominadas de micelas.
I. M. Rizzatti, D. R. Zanette e L. C. Mello. Determinação
potenciométrica da concentração micelar crítica de
surfactantes: uma nova aplicação metodológica
no ensino de química. In: Química Nova, v. 32,
n.° 2, 2009, p. 518-521 (com adaptações).
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

Deseja-se preparar duas soluções saturadas na temperatura de 20 °C, uma contendo o sal menos solúvel e outra contendo o sal mais solúvel nessa temperatura. Para cada uma das soluções, será empregado o mínimo possível dos sais e será utilizado 1 L de água, mantida a 20 °C durante todo o processo de dissolução. A massa específica da água é igual a 1.000 kg m-3.
Com base nesse caso hipotético e no gráfico, assinale a alternativa que apresenta, correta e respectivamente, as massas aproximadas dos dois sais necessárias para o preparo dessas soluções.
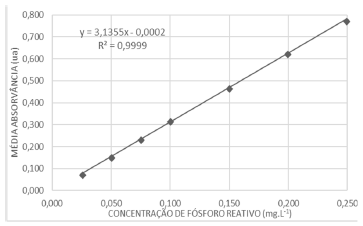
Nas mesmas condições analíticas uma amostra de água doce de um reservatório classe 2 com concentração desconhecida apresentou absorvância média 0,142 ua.
A concentração de fósforo reativo (em mg.L-1) na amostra é, aproximadamente, de
A alcalinidade total da amostra, em mgCaCO3.L-1, corresponde aproximadamente a
Dados: massas molares em g.mol-1: C = 12; O = 16; Ca = 40. Equação para a titulação: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Se a quantidade de matéria orgânica e de microrganismos aeróbios no esgoto for alta, a diminuição da concentração de oxigênio dissolvido no meio provocará alterações no ambiente aquático.
A quantidade de oxigênio necessária para o consumo da matéria orgânica pode ser avaliada em laboratório, utilizando o excesso do reagente
O volume previsto de titulado que deverá ser gasto nesse processo, considerando nenhum tipo de perda será de
Dados: massas molares (g.mol-1) C= 12; O=16; Na= 23.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Na = 23.
Foi realizada uma titulação de 50 mL de uma solução de um diácido fraco de concentração 0,1 mol/L. Como titulante foi utilizada solução de NaOH a 0,1 mol/L. O volume gasto para atingir o ponto de equivalência nessa titulação foi de 50 mL. Escolha, dentre as opções, o indicador (dada a faixa de viragem) menos apropriado para a titulação, considerando um erro de 1%.
(Dados para o diácido: pKa1 = 3 e pKa2 = 8.)
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?