Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.294 questões
Considerando esse contexto, assinale alternativa INCORRETA.
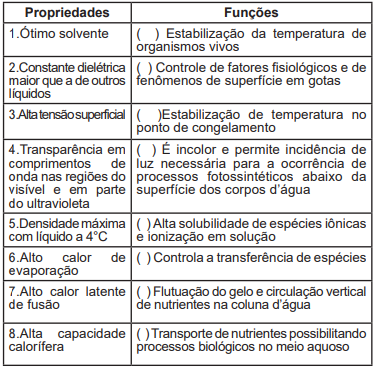
Assinale a alternativa que corresponde à ordem correta das correlações das propriedades com as funções, de cima para baixo segundo o que foi preenchido no quadro anterior:
Um técnico de laboratório precisava de uma solução 2000 mol/m3 de hidróxido de cálcio, muito usado como agente floculante para tratamento de efluentes. Ele encontrou sobre a bancada do laboratório dois frascos contendo soluções aquosas de hidróxido de cálcio: no primeiro frasco havia 2000 mL de solução 3 mol/L; no segundo frasco havia 1000 mL de solução 111 g/L. Considerando que o técnico utilizou toda a solução menos concentrada, o volume da solução mais concentrada necessário para obter a solução desejada é de:
Dados: H = 1 g/mol; O = 16 g/mol; Ca = 40 g/mol
Uma solução aquosa de bicarbonato de sódio (NaHCO3) foi preparada em um balão volumétrico de 250,00 mL utilizando-se 10,0 g do soluto, com o volume final ajustado pela adição de água pura. Dessa solução foi retirada uma alíquota de 25,00 mL, que foi transferida para um balão de 100,00 mL, no qual o volume final foi ajustado pela adição de água pura.
Os valores mais próximos das concentrações, em quantidade de matéria (mol L-1), da solução inicial e da solução após a diluição são, respectivamente,
Dado
M (NaHCO3) = 84,0 g mol-1
Assinale a alternativa que completa corretamente a lacuna.
“Para o preparo de 1L (litro) de solução de Hidróxido de Sódio (NaOH) 10M (molar), é necessário adicionar __________ de hidróxido de sódio (NaOH) em 500mL (mililitros) de água destilada e após, completar o volume para 1L (litro) com água destilada.”
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em um laboratório de análise química, há três tambores plásticos (X, Y e Z) destinados ao descarte de soluções e nos seus rótulos se lê os seguintes dizeres:
• Tambor X: descarte de soluções ácidas.
• Tambor Y: descarte de soluções básicas.
• Tambor Z: descarte de soluções neutras.
Ao perito desse laboratório, foi solicitado que fizesse o descarte de 3 soluções aquosas (1, 2 e 3), cujas características são descritas a seguir:
• Solução 1: cloreto de sódio 0,1 mol/L.
• Solução 2: mistura de 50 mL de ácido clorídrico 0,2 mol/L, com 20 mL de hidróxido de sódio 0,5 mol/L.
• Solução 3: glicose 0,1 mol/L (lembrando que a glicose é poliálcool que apresenta ainda um grupo aldeído (C6H12O6(aq))).
Considerando que o correto descarte tenha sido feito pelo perito, assinale a alternativa correta.
Uma análise iodométrica por titulação indireta foi utilizada para se determinar o teor de NaOCl de um desinfectante adquirido por uma estação de tratamento de água. Para isso, 25,0 mL do desinfectante foram diluídos a 1000 mL em um balão volumétrico. Um volume de 25,0 mL dessa solução diluída foi transferida para um erlenmeyer e tratada com excesso de KI, reduzindo OCl- a Cl- e produzindo I3- . A redução de I3- a I- foi executada via titulação com uma solução 0,10 mol L-1 de Na2S2O3, (que foi oxidado a Na2S4O6). Foram necessários 9,00 mL para se atingir o ponto de viragem do indicador utilizado. Assim, o percentual em %m/v, de NaOCl no desinfectante adquirido é de aproximadamente
Dados massas molares (g mol-1): O = 16; Na = 23; S = 32; Cl = 35,5; I = 127.