Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 1.859 questões
O técnico deve pipetar 1,5 mL da solução padrão estoque para preparar o padrão diluído a 30 mg/L nas condições indicadas.
Para realizar o correto descarte da solução titulada citada em III, são indicados a neutralização com bases e o descarte lento na pia, sob água corrente.
Para padronizar a solução titulante citada em III, é adequado o uso do dicromato de potássio como padrão primário.
Na titulação representada pela equação seguinte, o potencial no ponto de equivalência é igual à média aritmética dos potenciais padrão de redução dos dois pares redox envolvidos na reação.
U4+ + 2 Ce4+ + 2 H2O ⇌ UO2 2+ + 2 Ce3+ + 4 H+
Situação hipotética: Para a determinação da concentração de Cu2+ em uma bebida supostamente contaminada, foi utilizada a volumetria de complexação com EDTA. O álcool de uma alíquota de 100 mL dessa bebida foi evaporado, e o volume novamente completado a 100 mL com água pura. Após ser tamponada a pH 10, essa alíquota de 100 mL foi titulada com 12,5 mL de EDTA 0,004 mol/L. O único metal presente na amostra era o cobre, cuja massa molar é de 63,55 g/mol. Assertiva: Nessa situação, a concentração de cobre na bebida é maior que 25 mg/L.
No que concerne a volumetria, gravimetria e potenciometria, julgue o item a seguir.
Situação hipotética: Para padronizar uma solução de NaOH, um químico dissolveu em água 200 mg do padrão primário biftalato de potássio (KHC8H4O4; M = 204,1 g/mol), em um erlenmeyer. A solução resultante foi então titulada usando-se uma bureta e fenolftaleína como indicador. Foram consumidos 5,0 mL da solução de NaOH até o ponto final.
Assertiva: Nesse caso, a concentração da solução de NaOH
era menor que 0,2 mol/L.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.
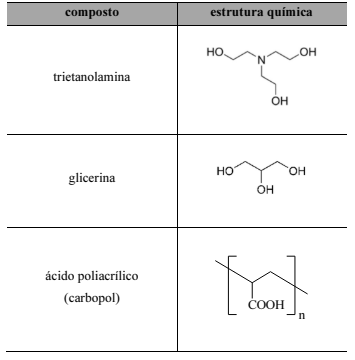
Em solução fortemente ácida, os grupos carboxila do carbopol encontram-se majoritariamente ionizados.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Entre os metais apresentados na tabela, o ferro é o mais facilmente oxidável.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
O anidrido bórico é um óxido obtido a partir da retirada total de moléculas de água da estrutura do ácido bórico e possui fórmula molecular BO3.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
A reação de neutralização parcial entre o ácido bórico e o hidróxido de cálcio na proporção de 1:1 pode formar o mono-hidrogenoborato de cálcio e duas moléculas de água.
Dados: Massas atômicas (u), em valores aproximados: K = 39; C = 12; H = 1; O = 16.
O valor que mais se aproxima da massa (em gramas) desse produto comercial necessária para preparar 500,00 mL da solução é:
Método
1. Método argentimétrico de Fajans. 2. Gravimetria por precipitação. 3. Titulação por complexação. 4. Titulação com permanganato de potássio (Permanganometria).
Aplicação
( ) Determinação do índice de dureza em água potável.
( ) Determinação do teor de íons cloreto em água.
( ) Determinação de peróxido de hidrogênio em água oxigenada.
( ) Determinação de íons cálcio em água salina, precipitando-o como oxalato de cálcio e pesando-o na forma de óxido de cálcio.
A ordem é, respectivamente,