Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Nessas condições, o valor da pressão de vapor do tolueno, em pascal, é

O complexo de Fe(II) com 1,10-fenantrolina tem seu máximo de absorção em 510 nm. Nesse comprimento de onda, foram obtidas as absorvâncias de quatro diferentes soluções padrões de Fe(II) preparadas em excesso de 1,10-fenantrolina (ver na tabela acima as absorvâncias já corrigidas pelo valor do branco).
A partir desses dados, conclui-se que

Assumindo que as condições para o comportamento previsto pela lei de Beer são obedecidas, o valor de absorvância medida para a solução, a 370 nm e usando uma cubeta de 1 cm de caminho óptico, é
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
II - Pelo fato de o valor do
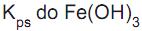 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido. III - O
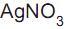 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz. IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em
entre a quantidade de soluto em mol por 1 kg de solvente). Na adição de 1 g de
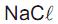 a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C.
a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C. Qual a molalidade (w) aproximada da solução aquosa de
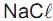 ?
?Com esses procedimentos, ele obteve uma solução final cuja concentração de OH- em quantidade de matéria (mol L-1 ) é
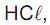 é uma substância composta que se ioniza quando dissolvida em água.
é uma substância composta que se ioniza quando dissolvida em água. 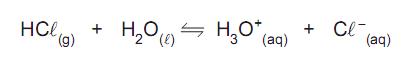
De acordo com a teoria ácido-base de Bronsted e Lowry, nessa ionização, a espécie que doa um próton é o ácido, e a que recebe o próton é a base. Por tratar-se de uma reação reversível, o ácido com a sua base conjugada são, respectivamente,
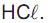 a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de
a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de 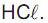
O volume da solução contida no frasco recém-adquirido que deve ser transferido para um cilindro graduado, visando ao preparo de 1,0 L de solução aquosa 0,15 mol L-1 , é
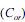 e na fase aquosa
e na fase aquosa 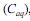 , quando atingido o
, quando atingido o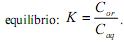
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
A fração do composto extraída pelo estudante B será maior que a extraída pelo estudante A.
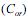 e na fase aquosa
e na fase aquosa 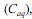 , quando atingido o
, quando atingido o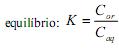
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
Considerando-se que o composto não sofra qualquer reação adicional nas fases aquosa e orgânica, é correto inferir que a porcentagem desse composto extraída pelo estudante A será maior que 80%.
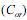 e na fase aquosa
e na fase aquosa 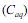 , quando atingido o
, quando atingido o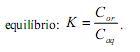
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
Caso o composto seja um ácido que sofra ionização em água, então, a fração extraída será tanto maior quanto mais elevado for o pH da fase aquosa.
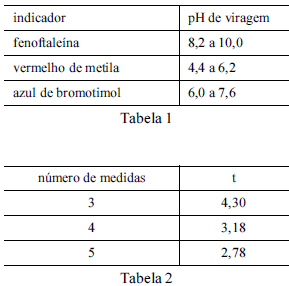
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes
Entre os indicadores apresentados na tabela 1, o mais
adequado à titulação em questão é o vermelho de metila.
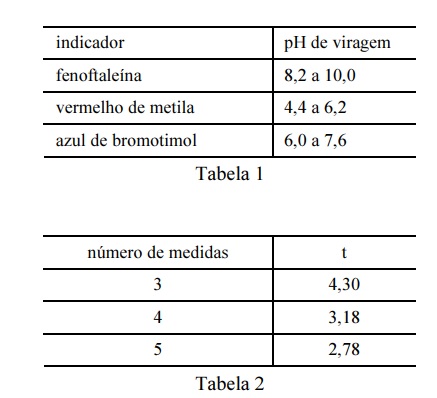
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes.
Considerando-se a inexistência de erros sistemáticos, é correto afirmar que a probabilidade de que o valor real da concentração de NaOH esteja no intervalo compreendido entre 0,078 e 0,082 será maior que 95%.

Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%. Com base nessas informações, julgue os itens seguintes.
A partir dos resultados obtidos, pode-se inferir que o volume
médio da solução de NaOH gasto na titulação é maior que
22,0 mL.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam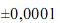 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 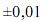 mL, para uma leitura de menisco no balão, julgue o próximo item.
mL, para uma leitura de menisco no balão, julgue o próximo item.
O desvio padrão relativo para a concentração da solução de biftalato de potássio preparada é maior que 1,0×10-4 .
Considerando as informações acima e que os desvios padrão sejam
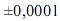 g, para uma simples leitura na balança utilizada,
g, para uma simples leitura na balança utilizada,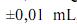 e , para uma leitura de menisco no balão, julgue os próximos itens.
e , para uma leitura de menisco no balão, julgue os próximos itens.Caso a solução de biftalato preparada seja usada, posteriormente, na padronização de uma solução básica, a presença de impurezas no biftalato usado para a preparação de sua solução gerará um erro aleatório que, consequentemente, afetará a precisão dos resultados obtidos durante a padronização.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Nos complexos de coordenação, os ligantes atuam como ácidos de Lewis.