Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Na etapa anterior ao forte aquecimento, pesou-se um sulfa- to ferroso hidratado (amostra), e a massa medida foi igual a 2,010 g. Após forte aquecimento em mufla, pesou-se o sulfato ferroso, sem a água de hidratação, e a massa medida foi igual a 1,095 g. De posse desses dados obtidos, conclui-se que o sal hidratado tem fórmula
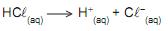
O volume, em mL, de solução aquosa de HCL0,1 mol/L necessário para o preparo de 1 L de solução com pH = 3 é

Se, no frasco Erlenmeyer, há 25,00 mL de HCL(aq) 0,200 mol/L, o volume de NaOH(aq) 0,100 mol/L que deve escoar da bureta, em mL, até se atingir o ponto estequiométrico, é


A charge faz uma critica às exigências de controle de qualidade para a certificação em produtos. Nessa perspectiva, considere que a massa desse projétil é 1,5 g. Logo, a massa de prata presente, em gramas, é aproximadamente
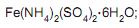 adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de
adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de 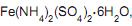 em gramas, utilizada nesse procedimento, foi de
em gramas, utilizada nesse procedimento, foi deDados : Constante do ponto de ebulição = 0,52 °C.kg.mol -1
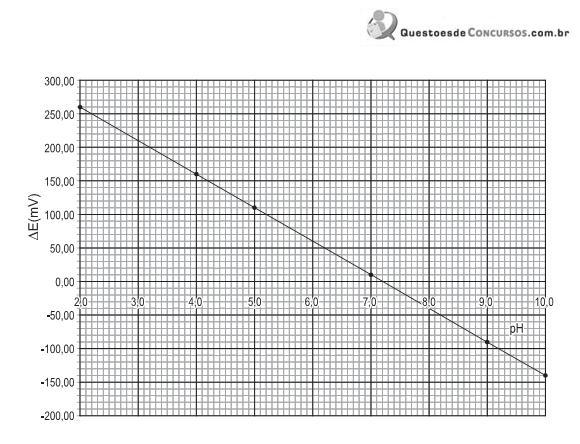
A partir da análise do gráfico, o módulo do fator de resposta, em mV/pH, é

Considerando-se que o grau de dissociação do
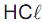 é de 30% e que no equilíbrio existe 1,4 mol de
é de 30% e que no equilíbrio existe 1,4 mol de 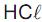 , qual o valor de n?
, qual o valor de n?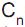 = 0,4 mol/L. Qual é a massa total, em gramas, de NaOH nessa solução?
= 0,4 mol/L. Qual é a massa total, em gramas, de NaOH nessa solução?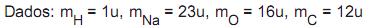
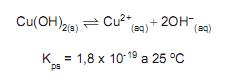
Sendo o valor do pH ideal da água da piscina igual a 6, a quantidade máxima de CuSO4 . 5H2 O em massa, que deve ser adicionada a uma piscina de volume igual a 10.000 L, com água no pH ideal, em kg, é
O bórax, de fórmula Na2 B4O7 · 10 H2O é um padrão primário utilizado para a padronização de solução de ácido clorídrico. Uma massa igual a 0,7628 g de bórax (massa molar = 381,4 g/mol) foi neutralizada com exatamente 25,00 mL de solução aquosa de HCl , segundo a equação abaixo:
Na2B4O7 · 10H2O + 2HCl → 2NaCl +4H3BO3 + 5H2O
De acordo com os dados experimentais, a concentração da solução aquosa de HCL em quantidade de matéria é
Qual o volume, em mililitros, da solução de NaOH gasto na titulação?

