Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Em meio aquoso, ele se ioniza de acordo com a equação simplificada (I) abaixo.
(I) HC2H3O2(aq)
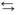 H+(aq) + C2H3O2−(aq)
H+(aq) + C2H3O2−(aq) Ácido clorídrico é um ácido muito forte e, em meio aquoso, ele se ioniza de acordo com a equação simplificada (II) abaixo.
(II) HCl(aq) → H+(aq) + Cl−(aq)
Na reação da base forte hidróxido de sódio 0,1 mol/L com o ácido etanoico 0,1 mol/L, e com o ácido forte
 0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações:
0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações: (III) NaOH(aq) + HC2H3O2(aq) → NaC2H3O2(aq) + H2O(l)
(IV) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sobre a ionização em (I) e (II) e as reações de neutralização em (III) e (IV), tem-se que:
A respeito dessas misturas, tem-se que
Dados:
Massa Atômica do Na = 23
Massa Atômica do S = 32
Massa Atômica do O = 16
A concentração da espécie MnO4- , em mol/L, nessa solução, é
Dado: M(KMnO4 ) = 158 g/mol
A massa de NaOH, em g, que deve ser utilizada para neutralizar todo o ácido sem que haja excesso de base é
Dados:
M(KOH) = 56 g/mol
M(NaOH) = 40 g/mol
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco
Dentre os sistemas abaixo, o único que NÃO é uma dispersão é
Representa uma dispersão coloidal o(a)
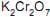 em água destilada com o volume sendo ajustado para 250,00 mL em balão volumétrico.
em água destilada com o volume sendo ajustado para 250,00 mL em balão volumétrico. A concentração da solução assim preparada, em mol/L, é igual a:
Dado:
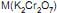 = 294 g/mol
= 294 g/mol O ponto final dessa titulação pode ser detectado por potenciometria, onde o potencial no ponto de equivalência em um sistema operando a 25 ºC e 1 atm é
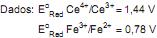
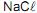 0.1 mol L-1 , sob as mesmas condições de temperatura e de pressão, constata-se que a
0.1 mol L-1 , sob as mesmas condições de temperatura e de pressão, constata-se que a A substância resultante da reação do sódio com a água é
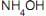 até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de
até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de 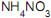 , (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.
, (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.A etapa que apresenta sua definição de acordo com os princípios da análise gravimétrica é:
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol
Nessa rotina, ocorre a seguinte reação química da cal virgem com a água:
Dados: C = 12; H = 1; O = 16