Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Dado: F = 19
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
Dados: H = 1; S = 32; O = 16; Na = 23
I. Mistura de mercúrio e ouro, da extração do minério aurífero.
II. Álcool (l) + Acetona (l).
III. Água (l) + Açúcar (s).
IV. Fração gasosa do petróleo (Metano + Etano + Propano + Butano).
constituem sempre sistemas homogêneos, qualquer que seja a proporção:
I. As temperaturas de fusão e ebulição servem para identificar e diferenciar substâncias puras das misturas.
II. As propriedades químicas são aquelas que não mudam a identidade de uma substância.
III. Toda matéria é constituída por átomos, moléculas ou íons que estão em movimento constante.
IV. Substâncias como hidrogênio e oxigênio, que são compostas de apenas um tipo de átomo, são classificadas como substâncias elementares ou simples.
verifica-se que estão corretas



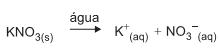
Qual é a concentração de K + , em mol/L, na solução preparada?
Dado
M(KNO3)=101 g/mol
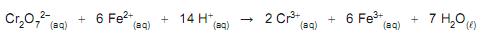
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a
Dado
M(Fe)=56g/mol

É correto APENAS o que se afirma em
Qual é a concentração de cobre, em mg/L, na amostra?
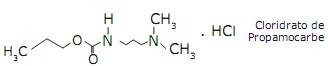
A massa do sal Cloridrato de Propamocarbe necessária para preparar 10 L de uma solução do Propamocarbe na sua forma de Base Livre com concentração 0,1 mol/L é
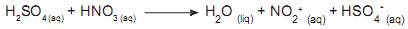
De acordo com esta equação química, podemos afirmar que ácido sulfúrico, ácido nítrico e ânion hidrogenosulfato (HSO4 - ) atuam respectivamente como
NÃO é uma dispersão coloidal a(o)
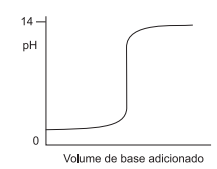
Considere a curva de titulação produzida quando uma base forte é adicionada a um ácido forte.
O pH da solução, quando 50 mL da base forte de concentração de 0,1 mol/L são adicionados a 51 mL do ácido forte de concentração de 0,1 mol/L, é de
Um químico dispõe de duas soluções estoque de NaC, uma de 1,7 mol/L (solução I) e outra de título 25% e densidade 2 g/mL (solução II), para preparar 500 mL da solução de cloreto de sódio 10% p/v.
Os volumes das soluções I e II para o preparo da solução desejada, quando usados separadamente são, respectivamente,
Dado:1 mol de NaCl corresponde a 58, 5 g de Nacl
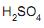 em peso; densidade 1,727 g/mL.
em peso; densidade 1,727 g/mL. A partir dessa identificação, conclui-se que a molaridade dessa solução é, aproximadamente, igual a
