Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
I – Sais são compostos formados por ânions provenientes de bases e por cátions provenientes de ácidos.
II – A maioria dos óxidos dos elementos fortemente eletronegativos tem caráter básico.
III – Os óxidos dos elementos fracamente eletronegativos apresentam ligação tipicamente iônica.
Está correto o que se afirma em

Sobre uma bancada de laboratório, há dois frascos com soluções aquosas de hidróxido de sódio com concentrações diferentes: um com uma concentração igual a 0,4 g/L, e outro com concentração de 0,2 g/L, como ilustrado na figura acima.
A transferência de 100 mL do frasco 1 e 200 mL do frasco 2 para um cilindro graduado, seguida da adição de água destilada até completar o volume de 1,0 L e da homogeneização completa, dá origem a uma solução cuja concentração de Na+, em mol/L, é igual a
Na2CO30,120mol/L.
A massa aproximada, em g, de Na2CO3 contida em 200 mL dessa solução é igual a Dado: M(Na2CO3) = 106 g/mol
Diz-se que a dosagem de um produto está na ordem de 1 ppb (parte por bilhão); então, a dosagem deste produto corresponde a:
Considerando que um tecido de algodão tenha sido alvejado com peróxido de hidrogênio à temperatura de 95 oC, durante 1 hora, e que o pH tenha ficado em 9, julgue os itens que se seguem.
Na situação descrita, o grau de branco ficou menor que o pH 12.
Assim, um soro pode ser diluído na proporção de 1:16, quando adicionadas
íons identificação nitrito I nitrato II sulfito III sulfato IV
O íon em que o átomo central apresenta conjunto de orbitais híbridos sp2 e o íon que apresenta geometria pirâmide trigonal são identificados na tabela, respectivamente, com os números
Dados: Densidade do etilenoglicol: 1,1 g cm-3 .
Densidade da água: 1,0 g cm-3
Kf = 1,9 K mol -1 Kg
H = 1 g mol -1 ; O = 16 g mol -1 ; C = 12 g mol -1
Dados:
Capacidade calorífica da água: 1 cal.g-1 . o C-1 .
Capacidade calorífica da solução neutralizada:1 cal.g-1 . o C-1 .
Densidade da água e de todas as soluções envolvidas: 1g.mL-1 .
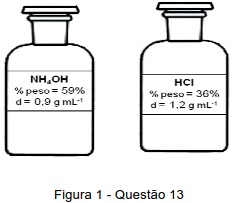
De acordo com as previsões do estudante, para produzir a quantidade de gás hidrogênio desejada ele deverá utilizar 500 mL de uma solução 6 mol L-1 preparada a partir de um dos reagentes acima. Indique a alternativa onde são apresentados, respectivamente, a identidade e o volume do reagente concentrado que o estudante deverá utilizar.
Dados: H = 1 g mol -1 ; N = 14 g mol -1 ; O = 16 g mol -1 ; Cl = 35,5 g mol -1 ; Zn = 65,4 g mol -1 .
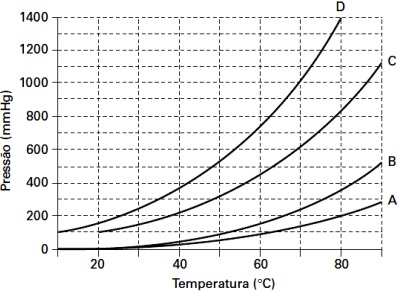
Figura 1 – Questão 11: Variação da pressão de vapor em função da temperatura para quatro diferentes substâncias puras.
Substância Massa Molar g mol-1 CHCl3 (Clorofórmio) 119,5
H2O (água) 18 CH3CH2OH (etanol) 46 CH2(OH)COOH (ácido glicólico) 76
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
As curvas apresentadas no gráfico foram obtidas em experimentos utilizando as substâncias listadas na Tabela 1. Identifique a alternativa que associa corretamente as curvas do gráfico às suas respectivas substâncias.
Dado: caminho óptico (b)= 1cm
Lei de Lambert-Beer A = ε b. c