Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Dados os seguintes valores de massas molares (g/mol): CaCO3: 100; HCl: 36,5; NaOH: 40.
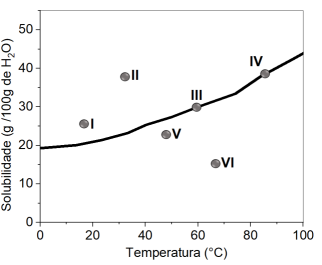
A partir da análise do perfil de solubilidade do sal, é correto afirmar que ocorre a formação de precipitado apenas nos seguintes sistemas:
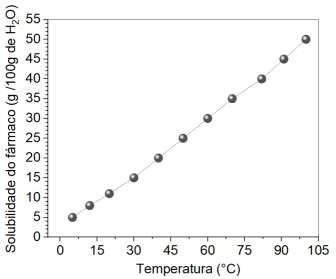
Se o químico optar por trabalhar com 40 g de água a 60°C, a quantidade máxima da substância que será dissolvida é:
AB(s) ⇌ A+ (aq) + B− (aq)
É correto afirmar que a solução saturada do sal, a 25°C, apresentará a seguinte concentração:
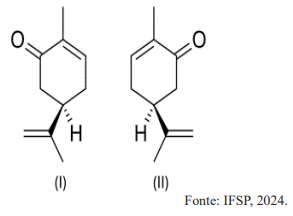
Com base nessas informações, é correto afirmar que:
Dados:
Considere que a constante dos gases ideais (R) seja igual a 8 J·mol-1·K-1 e que lnK = -
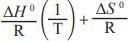
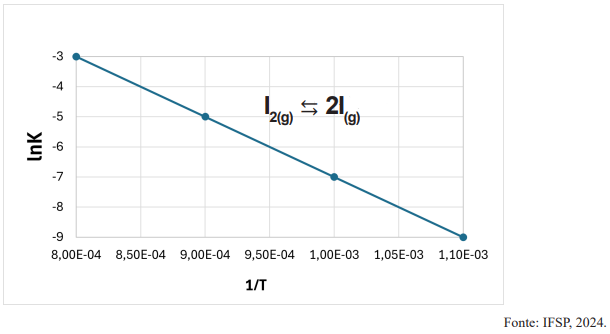
Com base nessas informações, é correto afirmar que:
Frasco A: REAÇÃO A : H2(g) + I2(g) ⇌ 2HI(g)
Frasco B: REAÇÃO B: 2NO2(g) ⇌ 2NO(g) + O2(g)
Considere os gases como ideias.
Se o volume de cada frasco for reduzido para um terço do volume inicial, é possível observar que:
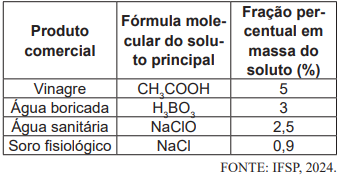
Uma pessoa possui, em sua casa, exatamente 100 mL de cada um dos produtos comerciais da tabela acima. Considerando os valores da fração percentual em massa do soluto na tabela acima, que a densidade de todas as soluções químicas é de 1,0 g mL-1 e que as soluções são formadas exclusivamente pelo soluto principal presente em água, escolha a alternativa que representa a menor concentração molar (mol L-1) do soluto em água.
Dados: H = 1,0 g mol-1; B = 10,8 g mol-1; C = 12,0 g mol-1; O = 16,0 g mol-1; Na = 23,0 g mol-1; Cl = 35,5 g mol-1
Fonte: SOUZA, Cleuzane R.; SILVA, Fernando C. Discutindo o contexto das definições de ácido e base. Química Nova na Escola, v. 40, n. 1, p. 14-18, 2018.
Considerando as informações do texto e a definição de Lewis para o conceito de ácido e base, analise os compostos indicados na tabela a seguir e assinale a alternativa correta:

Quanto às soluções, julgue o item seguinte.
Ocorre uma reação de precipitação quando iodeto de chumbo (PbI2) e nitrato de potássio (KNO3) reagem formando nitrato de chumbo (Pb(NO3)2) e iodeto de potássio (KI) sólidos, através da equação apresentada a seguir.
PbI2 (aq) + 2 KNO3 (aq) → Pb(NO3)2 (s) + 2 KI (s)