Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.139 questões
A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
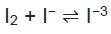
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
Os óxidos correspondem a uma classe de compostos que podem originar as bases e os ácidos, portanto são classificados de acordo com suas características ácido-base. Dentre os óxidos mais importantes, os NOx aparecem pela sua significância como poluentes atmosféricos. O NO2 e o NO são poluentes primários e o N2O, apesar de não ser um importante poluente da troposfera, acaba por exercer grande influência na estratosfera.
Considerando os óxidos em questão, na ordem apresentada no enunciado, indique a opção que relaciona corretamente a sua nomenclatura de óxido ao seu caráter ácido-base frente à reação com a água.
Uma amostra de 8g de hidróxido de sódio impuro foi dissolvida em água e seu volume levado a 1,0 litro em balão volumétrico. Desta solução, 50 mL foram titulados por 32 mL de HCℓ 0,25 mol/L.
O grau de pureza da amostra era de
A determinação de ânions cloreto na urina de um paciente do Hospital de Clínicas da UFU ocorreu por análise química de precipitação desse cloreto com solução aquosa de nitrato de prata. Para tanto, após coleta adequada, evaporou-se a urina e, no resíduo, adicionou-se água até o volume final de 1L. Uma alíquota de 25 mL foi transferida para um erlenmeyer, em que foram adicionados 50,0 mL de solução aquosa de nitrato de prata 0,120 mol/L.
A partir dos procedimentos descritos, e com a finalidade de determinar a quantidade de
cloreto na urina, o analista químico recomendou
Um técnico em análises químicas recebeu uma amostra de 0,101g de minério de ferro e supôs que a porcentagem de massa de ferro na amostra era superior a 20%. Para comprovar sua suposição, ele optou por dissolver a amostra em meio ácido e realizar uma titulação com solução aquosa 0,005 mol/L de permanganato de potássio. Foram consumidos 10,5 mL do titulante. A equação não balanceada que representa a reação é dada abaixo.

O ponto estequiométrico pôde ser percebido pela cor persistente do íon permanganato, indicando a transformação total do Fe (II) em Fe (III). A partir desses dados, é possível concluir que o técnico em química estava
Considere a figura a seguir.
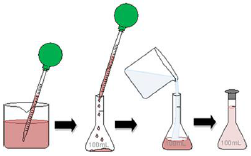
Disponível em: <http://alunosonline.com.br/upload/conteudo/images/diluicao-em-laboratorio.jpg>. Acesso em: 1º out. 2016.
A figura mostra etapas do preparo de uma solução cuja concentração resultante será
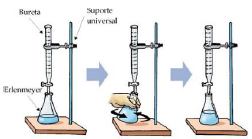
Disponível em: <http://quimicadodia-a-dia.blogspot.com.br/2012/11/titulacao.html>. Acesso em: 2 out. 2016.
A figura ilustra o processo de análise volumétrica que consiste na determinação da
concentração ou da quantidade de substância pela medida de volume, podendo ser
interpretada como uma
Marque a sequência correta de cima para baixo:
Na determinação da Demanda Química de Oxigênio − DQO de uma amostra de um efluente doméstico, 50 mL da amostra foram aquecidos por 2 horas, sob refluxo, com 30 mL de solução padronizada de K2Cr2O7 0,030 mol/L, na presença de H2SO4 concentrado. Após o aquecimento a amostra foi titulada com solução padronizada de FeSO4 0,060 mol/L, consumindo-se 25 mL desta solução.
Dados:
Massas molares (em g/mol):
K = 39 O = 16 S = 32 Fe = 56 Cr = 52 H = 1
Estequiometricamente:
1,0 mol de K2Cr2O7 equivale a 1,5 mols de gás O2.
1,0 mol de K2Cr2O7 equivale a 6 mols de FeSO4.
A DQO da amostra calculada, em mg/L de gás O2, é