Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Os indicadores são substâncias naturais ou sintéticas que apresentam cores bem distintas em ácido e básico. Para uma série de indicadores, as seguintes cores e faixa de pH sobre a qual a mudança de cor ocorre são apresentadas na tabela abaixo:

Assinale a alternativa que apresenta a afirmação
CORRETA:
Para atender aos procedimentos de rotinas laboratoriais, usamos vários tipos de soluções e concentrações. Para exemplificar, um técnico adicionou 100 mL de água destilada em 10 g de composto S, em pó e seco (CaCO3). A partir dos dados, obtiveram-se os resultados: (densidade da água, ρ = 1 g mL–1; massa molar do CaCO3 = 100 g mol–1):
I. Concentração comum: C = 0,1 g mL–1 .
II. Concentração molar: [X] = 0,5 mol L–1 .
III. Concentração molal: b = 1 mol kg–1 .
IV.Concentração percentual: %C = 10% m/V.
V. Fração molar de S: XS ≈ 0,1.
Assinale a alternativa correta:
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
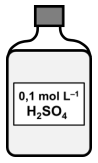
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
Analise as afirmativas abaixo sobre a classificação e propriedades dos óxidos, julgue se são VERDADEIRAS (V) ou FALSAS (F) e marque a alternativa que contém a sequência CORRETA.
( ) Os óxidos ácidos formam ácido quando reagem com água, e quando reagem com base formam sal e água.
( ) Óxidos neutros não reagem nem com água, ácido ou base. Podemos citar como exemplos de óxidos neutros o CO e o CO2.
( ) O óxido de cálcio, CaO, também chamado de cal viva, é um exemplo de óxido básico. Quando o CaO reage com a água, é formado o hidróxido de cálcio, Ca(OH)2, também chamado de cal hidratada ou cal extinta.
( ) O dióxido de enxofre é um óxido ácido e é um dos óxidos contribuintes para a chamada chuva ácida.
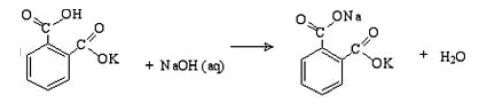 Na padronização de uma solução de NaOH um assistente de laboratório pesou uma massa de
0,5 g de hidrogenoftalato de potássio e gastou na titulação 25,0 mL de uma solução de NaOH de
concentração desconhecida. Qual é a concentração aproximada do NaOH em mol/L?
Na padronização de uma solução de NaOH um assistente de laboratório pesou uma massa de
0,5 g de hidrogenoftalato de potássio e gastou na titulação 25,0 mL de uma solução de NaOH de
concentração desconhecida. Qual é a concentração aproximada do NaOH em mol/L?
Dados: Massa molar do hidrogenoftalato de potássio: 204,2 g/mol; Massa molar do hidróxido de sódio: 40,0 g/mol
O íon potássio em 250,0 mL de uma amostra de água mineral foi precipitado com tetrafenilborato de sódio:
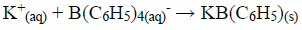
O precipitado foi filtrado, lavado e redissolvido em um solvente orgânico. Um excesso de quelato EDTA/mercúrio(II) foi adicionado:
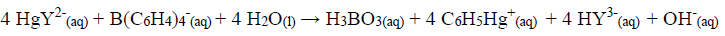
O EDTA liberado foi titulado com 30,00 mL de Mg2+ 0,0550 mol L-1.
(Dado: K = 39 g mol-1, Mg = 24 g mol-1)
Após a análise, a concentração aproximada do íon potássio em partes por milhão será:
Defensivos agrícolas são intensamente usados na proteção das plantações. A concentração do produto aplicado prescrita por agrônomos depende da pureza do produto. O Captan (C9H8O2Cl3NS) é um fungicida especialmente eficiente contra a praga de ferrugem. Na sua forma pura é uma substância cristalina branca, com ponto de fusão de 175°C, pouco solúvel em água. Um produto de grau técnico, de cor acinzentada, com ponto de fusão de 164°C, foi levado a um laboratório químico para análise. Uma amostra de 0,5500 g foi pesada e corretamente manipulada para se proceder a hidrólise e subsequente liberação dos íons cloreto e da tetrahidroftalimida (C8H9NO2). A seguir foi cuidadosamente tratada com 50,00 mL de uma solução padrão de AgNO3 0,1000 mol L-1. O excesso destes íons Ag+ foi titulado com outra solução padrão de KSCN 0,0500 mol L -1, gastando-se 10,00 mL até atingir o ponto final da titulação, utilizando como indicador uma pequena quantidade de íons Fe3+.
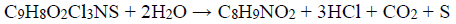
Dados: C9H8O2Cl3NS; 300,5 g mol-1 , C8H9NO2;151 g mol-1
Com base nas informações fornecidas pelo problema é CORRETO afirmar: