Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.297 questões
Um copo, com capacidade de 250 mL, contém 100 mL de uma solução aquosa 0,10 mol L-1 de ácido acético na temperatura de 25°C. Após a adição de mais 100 mL de água pura a essa solução, com a temperatura permanecendo constante, as consequências sobre a concentração de íons acetato (mol L-1) e quantidade de íons acetato (mol), respectivamente são:
Dados: Ka = 1,8.10-5, √1,8x10-6 = 0,0013 e √9x10-7
= 0,0095.
Julgue o item subsequente, relativo a soluções.
Considere que a solubilidade do sal de cozinha (NaCl) em
água, a temperatura ambiente (de 20 ºC) e pressão atmosférica
normal (de 1 atm ao nível do mar) seja igual a 0,36. Nesse
caso, é impossível dissolver 500 g de sal em 1 L de água,
mesmo que se aqueça a solução.
X, Y e Z representam genericamente três ácidos que, quando dissolvidos em um mesmo volume d’água, à temperatura constante, comportam-se de acordo com a tabela:

Considere as afirmações em relação aos três ácidos:
I- X representa o maior grau de ionização.
II- Y representa o ácido mais forte.
III- Z representa o ácido mais fraco.
Está(ão) correta(s) a(s) afirmativa(s)
Considere a reação a seguir:
NaOH + H2SO4 → Na2SO4 + H2O

A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
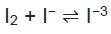
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
Os óxidos correspondem a uma classe de compostos que podem originar as bases e os ácidos, portanto são classificados de acordo com suas características ácido-base. Dentre os óxidos mais importantes, os NOx aparecem pela sua significância como poluentes atmosféricos. O NO2 e o NO são poluentes primários e o N2O, apesar de não ser um importante poluente da troposfera, acaba por exercer grande influência na estratosfera.
Considerando os óxidos em questão, na ordem apresentada no enunciado, indique a opção que relaciona corretamente a sua nomenclatura de óxido ao seu caráter ácido-base frente à reação com a água.
Uma amostra de 8g de hidróxido de sódio impuro foi dissolvida em água e seu volume levado a 1,0 litro em balão volumétrico. Desta solução, 50 mL foram titulados por 32 mL de HCℓ 0,25 mol/L.
O grau de pureza da amostra era de
A determinação de ânions cloreto na urina de um paciente do Hospital de Clínicas da UFU ocorreu por análise química de precipitação desse cloreto com solução aquosa de nitrato de prata. Para tanto, após coleta adequada, evaporou-se a urina e, no resíduo, adicionou-se água até o volume final de 1L. Uma alíquota de 25 mL foi transferida para um erlenmeyer, em que foram adicionados 50,0 mL de solução aquosa de nitrato de prata 0,120 mol/L.
A partir dos procedimentos descritos, e com a finalidade de determinar a quantidade de
cloreto na urina, o analista químico recomendou