Questões de Concurso
Sobre substâncias e suas propriedades em química
Foram encontradas 1.515 questões
I. Átomos que apresentam seus elétrons de valência exclusivamente no subnível s possuem maior eletronegatividade do que átomos com elétrons de valência no subnível p. II. O caráter iônico de uma ligação química depende da diferença de eletronegatividade entre os átomos envolvidos. III. Todos os halogênios apresentam 7 elétrons no subnível p do último nível eletrônico.
São VERDADEIRAS apenas a(s) afirmativa(s):
I. Teremos duas fases nos frascos B e C, pois tanto a água quanto o etanol não estabelecem ligações de hidrogênio com a gasolina. II. No frasco A teremos uma única fase, pois a água e o álcool etílico são solúveis em todas as proporções dadas as ligações de hidrogênio que se estabelecem entre suas moléculas. III. Ao misturarmos os três frascos, observaremos três fases distintas, pois as densidades das substâncias são diferentes.
Assinale a alternativa em que toda(s) a(s) afirmativa(s) está(ão) CORRETA(S):
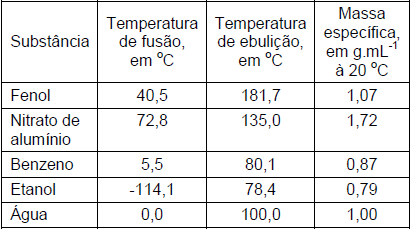
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
Texto para a questão.
Entre os elementos conhecidos, alguns são familiares a todos e outros são bastante raros. Algumas das substâncias elementares são metais e outras, não. À temperatura ambiente, alguns são gases, alguns, líquidos e outros, sólidos. Variam eles extremamente nas propriedades químicas e na natureza dos compostos que formam. Como consequência, estudar química não é simples nem fácil. Para se adquirir conhecimento razoável de química geral, é necessário aprender um grande número de fatos. Não existe uma teoria que unifique todos esses fatos completamente. Contudo, várias teorias foram desenvolvidas suficientemente para servir de ajuda ao estudante na tarefa de aprender algo sobre as propriedades e reações das substâncias, correlacionando informações empíricas com teorias, como, por exemplo, a lei periódica.
L. Pauling. Química Geral. Rio de Janeiro: Ao Livro
Técnico e Edusp, 1966 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Álcool etílico hidratado é uma mistura homogênea.
Para demonstrar como realizar a separação de misturas, certo professor pediu que os alunos se dividissem em quatro grupos e escolhessem equipamentos que pudessem ser utilizados para separar misturas via sublimação. As escolhas dos grupos estão descritas no quadro a seguir. Observe.

Assinale o grupo que selecionou os equipamentos corretamente para essa separação de misturas.
Analise a figura acerca do ponto triplo.
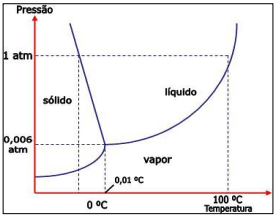
De acordo com a imagem anterior, assinale a alternativa correta.
Em seus compostos, o enxofre apresenta números de oxidação +6, +4, +2 e –2. São várias as espécies em solução ácida e básica. Nas espécies protonadas, os átomos de H estão ligados aos átomos de oxigênio dos oxiânicos. As espécies sulfuradas possuem diferentes potenciais padrão. Há de se notar que os oxiânicos de enxofre são agentes oxidantes muito mais fracos do que os de nitrogênio. Ainda sobre espécies de enxofre, analise as afirmativas a seguir.
I. Espécies no estado +6, no estado +4 e no estado +2 podem atuar apenas como agentes oxidantes, e nunca como agentes redutores, em reações redox.
II. Espécies no estado 0 (zero) podem atuar como agentes oxidantes ou como agentes redutores.
III. Espécies no estado –2 podem atuar apenas como agentes redutores, e nunca como agentes oxidantes, em reações redox.
Estão corretas as afirmativas
Considere os seguintes compostos:
I. Na2S2O3 − utilizado na remoção de cloro de águas de abastecimento.
II. MgSO4 − um dos compostos responsáveis pela dureza das águas
III. HCℓO − formado pela dissociação do cloro em águas de abastecimento.
No que diz respeito ao tipo de ligação química que estas substâncias apresentam é correto afirmar que
Sabendo-se que o fator de retenção (RF) da substância I foi de 0,9, que o da substância II foi de 0,6 e que os diâmetros das manchas foram de 0,2 cm, conclui-se que a
A água é a molécula responsável pela vida no planeta Terra. A molécula de água tem duas ligações simples e geometria angular.
Sobre a molécula da água, tem-se que as ligações
Uma solução é definida por ser uma mistura homogênea de duas ou mais substâncias.
Nesse sentido, as duas misturas a seguir são consideradas homogêneas:
