Questões de Concurso
Sobre substâncias e suas propriedades em química
Foram encontradas 1.556 questões
Considerando as espécies químicas H+
, Cu+
, Mg2+, BF3, Au+
, NH4+
, BH3, F-
, NH3, I- e
C6H6, responda a questão.
Sobre as espécies apresentadas não se pode afirmar que
Considere as seguintes reações.
1. HCl + NH3 ⇌ NH4 Cl
2. CH3COOH +H2O (l) ⇌ CH3COO- (aq) + H3O+ (aq)
3. NH3 + BF3 ⇌ H3N-BF3
4. CH3CH2COOH + H2O (l) ⇌ CH3CH2COO- (aq) + H3O+ (aq)
Sobre as substâncias nelas presentes é INCORRETO afirmar que
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
I – Aqueles com maior ponto de fusão são os óxidos de sódio e magnésio. II – O enxofre forma mais de um óxido. III – A ligação entre Mg e O é a que apresenta maior caráter iônico. IV – O dióxido de cloro (ClO2) apresenta fórmulas de Lewis com híbridos de ressonância.
Está correto o que se afirma em
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
Considerando as substâncias formadas pela ligação química de um átomo de carbono com i) 4 átomos de hidrogênio, ii) dois átomos de oxigênio e iii) um átomo de oxigênio e dois de hidrogênio, tem-se as afirmativas:
I- Uma das moléculas formadas apresenta geometria trigonal plana.
II- Uma delas possui ângulo de ligação igual a 104,5 °.
III- Todos são moléculas polares.
IV- Entre as forças intermoleculares presentes, não há, em nenhum caso, ligação de hidrogênio.
V- O composto formado por carbono e oxigênio deve apresentar o menor ponto de fusão entre os três.
Está correto o que se afirma em
I- Devido à eletronegatividade de seus elementos, possui geometria angular. II- Sua base conjugada é o íon carboneto. III- Trata-se de um composto covalente. IV- Seu átomo de carbono tem hibridação sp3 . V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Os sólidos estão divididos em duas grandes categorias: sólidos cristalinos e sólidos amorfos. Por sua vez os sólidos cristalinos podem ser iônicos, covalentes ou metálicos. Analise as proposições abaixo, e assinale com V as verdadeiras e com F as falsas.
( ) Os sólidos amorfos, líquidos super-resfriados ou vidros apresentam partículas dispostas desordenadamente.
( ) O diamante apresenta ligações com orbitais sp2 e o grafite apresenta ligações com orbitais sp3.
( ) O dióxido de silício é um sólido covalente porque cada átomo de oxigênio está ligado a dois átomos de silício.
( ) Nos sólidos metálicos existe uma rede em que os pontos reticulares estão ocupados por íons unidos por ligações do tipo metálico não direcionais.
( ) Gelo e dióxido de carbono são exemplos de sólidos moleculares porque possuem unidades moleculares discretas com ligações dipolares ou de hidrogênio.
A sequência correta, de cima para baixo, é
A geometria molecular e o tipo de hibridação do átomo central no tetrafluoreto de xenônio são, respectivamente,

A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A molécula de H2O2 é apolar e apresenta menor ponto de
ebulição normal do que a água.


Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
O sulfeto de sódio é um sólido molecular.
I. Átomos que apresentam seus elétrons de valência exclusivamente no subnível s possuem maior eletronegatividade do que átomos com elétrons de valência no subnível p. II. O caráter iônico de uma ligação química depende da diferença de eletronegatividade entre os átomos envolvidos. III. Todos os halogênios apresentam 7 elétrons no subnível p do último nível eletrônico.
São VERDADEIRAS apenas a(s) afirmativa(s):
I. Teremos duas fases nos frascos B e C, pois tanto a água quanto o etanol não estabelecem ligações de hidrogênio com a gasolina. II. No frasco A teremos uma única fase, pois a água e o álcool etílico são solúveis em todas as proporções dadas as ligações de hidrogênio que se estabelecem entre suas moléculas. III. Ao misturarmos os três frascos, observaremos três fases distintas, pois as densidades das substâncias são diferentes.
Assinale a alternativa em que toda(s) a(s) afirmativa(s) está(ão) CORRETA(S):
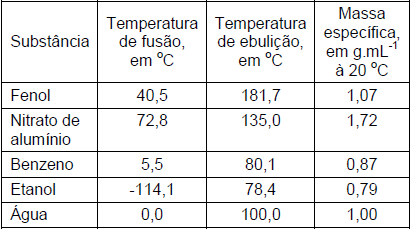
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
Texto para a questão.
Entre os elementos conhecidos, alguns são familiares a todos e outros são bastante raros. Algumas das substâncias elementares são metais e outras, não. À temperatura ambiente, alguns são gases, alguns, líquidos e outros, sólidos. Variam eles extremamente nas propriedades químicas e na natureza dos compostos que formam. Como consequência, estudar química não é simples nem fácil. Para se adquirir conhecimento razoável de química geral, é necessário aprender um grande número de fatos. Não existe uma teoria que unifique todos esses fatos completamente. Contudo, várias teorias foram desenvolvidas suficientemente para servir de ajuda ao estudante na tarefa de aprender algo sobre as propriedades e reações das substâncias, correlacionando informações empíricas com teorias, como, por exemplo, a lei periódica.
L. Pauling. Química Geral. Rio de Janeiro: Ao Livro
Técnico e Edusp, 1966 (com adaptações).