Questões de Concurso
Sobre substâncias inorgânicas: dissociação iônica e ionização, conceitos de ácido-base. em química
Foram encontradas 389 questões
Assinale a alternativa que apresenta o esquema que melhor expressa esse equilíbrio.
Situação 1: preparo de uma solução aquosa de sulfato de magnésio
Situação 2: neutralização de trifluoreto de boro por amônia
De acordo com a teoria ácido-base de Lewis, identifique o resultante em cada situação.
No pré-tratamento de material lignocelulósico por via ácida
empregando ácido sulfúrico, foram obtidos 200 m3 de
hidrolisado rico em pentoses. A concentração de ácido sul-
fúrico neste hidrolisado é igual a 2 x 10-2 mol/L. Visando a
aproveitar esse hidrolisado para a produção de etanol de
segunda geração a partir da fermentação das pentoses,
foi feito um tratamento por overliming, tendo sido utilizado
óxido de cálcio e empregando-se 25% de excesso deste
em relação à quantidade estequiométrica necessária para
a neutralização.
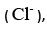 precipitado na forma de cloreto de prata (AgCl).
precipitado na forma de cloreto de prata (AgCl). A difusividade mássica binária através de gases pode ser encontrada tabelada, para algumas temperaturas e pressões. O valor tabelado de DAB do etanol através do ar, para a temperatura de 25ºC e pressão de 760 mmHg é igual a 0,132 cm2/s. Calcule a difusividade do etanol através do ar, para a temperatura de 25ºC e pressão de 2 atm, utilizando o valor informado acima e a Equação de Chapman-Enskog, dada por:
onde DAB é dado em cm2/s, P em atm, ΩD é adimensional e depende da temperatura, MA e MB são as massas moleculares das espécies químicas A e B, respectivamente, T é a temperatura em K e σAB = (σA+ σB)/2, sendo que σA e σB são os parâmetros de Lennard-Jones das espécies químicas A e B, respectivamente. O novo valor da difusividade DAB obtido é dado por:
No tratamento de efluente por processos físico-químicos, são utilizados floculantes à base de Al2(SO4)3 ou FeCl3. A reação que produz a floculação ocorre em meio alcalino, de acordo com as reações descritas abaixo.
a Al2(SO4)3 + b NaOH c Al(OH)3 + d Na2SO4
e FeCl3 + f NaOH g Fe(OH)3 + h NaCl
Com relação às reações acima, pode-se afirmar que:
O monóxido de carbono (CO) é uma substânciaaltamente tóxica, pois forma complexos estáveis com o ferro dahemoglobina impedindo que essa proteína capture o oxigêniomolecular necessário para o processo respiratório. Considere que Z(C) = 6 e Z(O) = 8.
A respeito desse tema, julgue os itens que se seguem.
A respeito da classificação das substâncias e suas características, julgue os itens.
A mistura coloidal de gelatina em água, a fumaça do escapamento de um ônibus e o leite são exemplos de soluções coloidais, respectivamente, denominadas:
Sabe-se que a solubilidade do KNO3 (nitrato de potássio) em água é igual a 31,6g/100g de água a 20°C e que esta solubilidade aumenta para 110g/100g de água quando a temperatura é de 60°C. Admita que 100g de KNO3 foram dissolvidos em 100g de água a 60°C. Depois, esta solução foi resfriada a 20°C e submetida à vigorosa agitação e em seguida, foi deixada em repouso. Pode-se observar que:
Para determinar a concentração de uma solução de hidróxido de potássio, titulou-se 40mL desta solução usando uma solução de ácido clorídrico 0,1mol/L. Nesta titulação foi gasto 20mL da solução de HCl. Assinale a concentração da solução de KOH:
Considere os seguintes dados referentes a uma reação química:
|
Reagentes |
Produtos |
||
|
[A] |
[B] |
[C] |
[D] |
Estado Inicial |
1 |
2 |
0 |
0 |
Estado de Equilíbrio |
0,5 |
0,5 |
0,5 |
0,5 |
Assinale a alternativa correta:
Dentre os sais abaixo, aquele que gera uma solução com caráter ácido, ao ser dissolvido em água, é o
PORQUE
HBr e HI transferem de forma praticamente completa os seus prótons para a água, formando H₃O+.
A esse respeito conclui-se que
